Целулоза
Целулоза је природни макромолекул који настаје фотосинтезом.[5] Целулоза (лат. cellula: мала ћелија) је у природи најраспрострањеније угљениково једињење на Земљи. То је Угљени хидрат (полисахарид) с великом релативном молекуларном масом. Састоји се од анхидрида глукозе емпиријске формуле (C6H10O5)n. Целулоза припада групи полисахарида који представљају до 80% суве материје биљног света, а међу којима је целулоза најзначајнија. Потпуном хидролизом целулозе добија се D – глукоза. Основу целулозе чине у ствари, два анхидрида D – глукозе, који су везани глукозидном везом и чине молекул целобиозе. Испитивањем се дошло до закључка да је целулоза полисахарид изграђен од великог броја молекула D – глукозе, повезаних глукозидном везом.
| |

| |
| Идентификација | |
|---|---|
| ChemSpider | |
| ECHA InfoCard | 100.029.692 |
| EC број | 232-674-9 |
| Е-бројеви | E460 (згушњивачи, ...) |
| UNII | |
| Својства | |
| (C 6H 10O 5) n | |
| Моларна маса | 162,1406 g/mol по глукозној јединици |
| Агрегатно стање | бели прах |
| Густина | 1,5 g/cm3 |
| Тачка топљења | 260—270 °C; 500—518 °F; 533—543 K разлаже се[4] |
| н/а | |
| Термохемија | |
Стандардна енталпија
стварања (ΔfH |
−963.000 kJ/mol |
Стд енталпија
сагоревања (ΔcH⦵298) |
−2828.000 kJ/mol |
| Опасности | |
| NFPA 704 | |
| Границе изложености здравља у САД (NIOSH): | |
PEL (дозвољено)
|
TWA 15 mg/m3 (укупно) TWA 5 mg/m3 (респ)[4] |
REL (препоручено)
|
TWA 10 mg/m3 (укупно) TWA 5 mg/m3 (респ)[4] |
IDLH (тренутна опасност)
|
N.D.[4] |
| Сродна једињења | |
Сродна једињења
|
Скроб |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |



Већином се налази у облику влакана, која су врло чврста, нерастворна у води, слабим киселинама и лужинама, те у органским растварачима.[6][7][8] Целулоза настаје у природи фотосинтезом и чини готово половину материје од које су грађене ћелијски зидови у дрвећу и једногодишњим биљкама. За производњу папира употребљава се такозвана техничка целулоза, која осим чисте целулозе садржи мањи или већи удео хемицелулозе и лигнина, те незнатне количине смоле, воскова и минералних материја.[9]
Целулоза је најзаступљенији органски полимер на Земљи.[10] Удео целулозе у памуку је до 98%, у дрву 40 до 50%, у слами око 30%.[11][12][13] Целулоза је основни састојак многих данас незаменљивих индустријских производа: папира, картона, лепенке, вате и целулозних влакана за текстилну индустрију, а широку примену налазе и њени деривати (естери и етери) у производњи лакова, експлозива, лепака, филмских трака, целулоида и другог. Целулоза је полисахарид с бруто једначином (C6H10O5)n, при чему је n ступањ полимеризације, који за памук приближно износи 7 000, а за јелово дрво 2 500. Ланчани молекули целулозе грађени су од гликозидно повезаних молекула глукозе, а обрадом киселинама целулоза се хидролитички разграђује. Хемијском реакцијом азотне и сумпорне киселине с целулозом настаје целулозни нитрат (познат и под називом нитроцелулоза), а деловањем анхидрида сирћетна киселине ацетилцелулоза. Многе животиње пробављају целулозу помоћу ензима целулазе и хемицелулазе. У цревима сисара целулоза се разграђује деловањем ензима бактеријске цревне флоре и разних праживотиња. Преживари и коњи пробаве 30 до 75% целулозе, а месождерне је животиње уопште не могу пробавити, као ни човек, јер немају ензиме потребне за њену разградњу. Целулозе има највише у воћу и поврћу и врло је важан удео прехране.[14]
Историја уреди
Целулозу је 1838. године открио француски хемичар Анселm Пајен, који ју је изоловао из биљне материје и одредио њену хемијску формулу.[6][15][16] Компанија Hyatt Manufacturing је користила целулозу за производњу првог успешног термопластичног полимера, целулоида 1870. године. Производња рејона („вештачке свиле“) из целулозе започела је 1890-их, а целофан је изумљен 1912. Херман Штаудингер је одредио полимерну структуру целулозе 1920. Једињење су први пут хемијски синтетисали (без употребе било којих биолошки изведених ензима) Кобајаши и Шода 1992. године.[17]
Добијање уреди
Целулоза се производи изолацијом (издвајањем) из црногоричнога (смрека, јела, бор) и белогоричног дрвета (топола, буква, бреза) и других влакнастих сировина (памук, лан, конопља, јута, слама) у облику станичевине, влакнасте материје која може садржати и до 99% целулозе. Обрадом механички уситњене и очишћене сировине хемикалијама на повишеној температури уклањају се лигнин, смола и непожељни природни полисахариди (хемицелулоза). Начин и ступањ уклањања примеса одређују удео целулозе у производу, а зависе од његове намене и употребе. Највише се примјењује сулфатни поступак (добија се сулфатна целулоза у облику дугих и чврстих влакана), у којем се целулозна маса након искувавања (5 сати на 100 до 180 °C) с натријум хидроксидом и натријум сулфидом одваја од преосталога луга, чисти, пере и по потреби избељује. Луг се регенерира испаравањем, додавањем натријум сулфата ради надокнаде потрошеног натријума, спаљивањем и каустифицирањем. Сличан је и натронски (содни) поступак, у којем је активна алкалија натријум хидроксид, а луг се регенерише натријум карбонатом. Због мање обојености производа пре бељења, пре се више примењивао сулфитни поступак, у којем се за искувавање сировине употребљавала сумпораста киселина и калцијум хидрогенсулфит. У том се поступку луг није регенерисао, а његово је секундарно искориштавање било ограничено. Деломична регенерација луга могућа је употребом магнезијум хидрогенсулфита, што је у еколошком смислу много повољније.
Производи уреди
Целулоза је основни састојак многих данас незамјењивих индустријских производа: папира, марамица (на пример салвете џепне, тоалетне, кухињске, и тако даље), картона, лепенке, вате (најчешће то буде памучна) и целулозних влакана за текстилну индустрију. Широку примену налазе и њени деривати (естери и етри) у производњи лакова, експлозива, лепака, филмова, целулоида, синтетске вате и тканине и другог.
Деловање киселина на целулозу уреди
Краткотрајним деловањем сумпорне киселине целулоза прелази у набубрену колоидну модификацију амилоида, који се употребљава за производњу пергаментнога папира.
Деловањем (реакцијом) азотне киселине у смеши са сумпорним киселином, прелази у нитроцелулозу, сировину у производњи бездимнога барута (целулозног нитрата), целулоида, вискозе и целофан а.
С анхидридом сирћетне киселине целулоза прелази у ацетате (такозвана ацетилцелулоза), која се употребљава за производњу пластике и вештачких влакана (ацетатне свиле).
Структура и својства уреди
Целулоза нема укус, нити мирис, хидрофилна је са контактним углом од 20–30 степени,[18] нерастворљива је у води и већини органских растварача, хирална је и биоразградива. Показало се да се топи на 467 °C у пулсним тестовима које су направили Дауенхауер et al. (2016).[19] Она се може хемијски разложити на своје глукозне јединице третирањем концентрованим минералним киселинама на високој температури.[20]
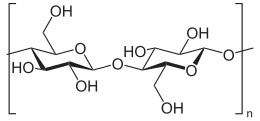
Целулоза се добија од јединица D-глукозе, који се кондензују кроз β(1→4)-гликозидне везе. Овај мотив везе је у супротности са мотивом за α(1→4)-гликозидне везе присутне у скробу и гликогену. Целулоза је полимер равног ланца. За разлику од скроба, не долази до намотавања или гранања и молекул усваја продужену и прилично круту конформацију налик штапићу, уз помоћ екваторијалне конформације остатака глукозе. Вишеструке хидроксилне групе на глукози из једног ланца формирају водоничне везе са атомима кисеоника на истом или на суседном ланцу, држећи ланце чврсто заједно један поред другог и формирајући микрофибриле високе затезне чврстоће. Ово даје затезну чврстоћу у ћелијским зидовима где су микрофибриле целулозе спојене у полисахаридну матрицу. Висока затезна чврстоћа стабљика биљака и стабала такође произилази из распореда целулозних влакана који су интимно распоређени у лигнинском матриксу. Механичка улога целулозних влакана у дрвеној матрици одговорна за њену јаку структурну отпорност, донекле се може упоредити са оном коју имају арматурне шипке у бетону, при чему лигнин игра улогу очврсле цементне пасте која делује као „лепак“ између целулозних влакна. Механичка својства целулозе у примарном ћелијском зиду биљака су у корелацији са растом и експанзијом биљних ћелија.[21] Технике живог флуоресцентног микроскопа пружају обећавајуће могућности у истраживању улоге целулозе у растућим биљним ћелијама.[22]
Целулоза у додиру са водом бубри, утолико више уколико је више аморфних подручја у влакну. Од количине упијене воде зависе механичке особине целулозе, тј. веће бубрење смањује механичку отпорност. Органски растварачи изазивају слабије бубрење од воде.[23]
Поларни растварачи (хлороформ) показују већу моћ продирања у влакна целулозе, од неполарних растварача (угљен дисулфид). Способност упијања влакна појачана је после третирања са 20% натријум хидроксида.
Референце уреди
- ^ Nishiyama, Yoshiharu; Langan, Paul; Chanzy, Henri (2002). „Crystal Structure and Hydrogen-Bonding System in Cellulose Iβ from Synchrotron X-ray and Neutron Fiber Diffraction”. J. Am. Chem. Soc. 124 (31): 9074—82. PMID 12149011. doi:10.1021/ja0257319.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г NIOSH Џепни водич хемијских хазарда. „#0110”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ David L. Nelson; Michael M. Cox (2005). Principles of Biochemistry (IV изд.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ а б Crawford, R.L. (1981). Lignin biodegradation and transformation. New York: John Wiley and Sons. ISBN 978-0-471-05743-7.
- ^ Updegraff D.M. (1969). „Semimicro determination of cellulose in biological materials”. Analytical Biochemistry. 32 (3): 420—424. PMID 5361396. doi:10.1016/S0003-2697(69)80009-6.
- ^ Romeo, Tony (2008). Bacterial biofilms. Berlin: Springer. стр. 258–263. ISBN 978-3-540-75418-3.
- ^ "Tehnička enciklopedija" (Papir), glavni urednik Hrvoje Požar, Grafički zavod Hrvatske, 1987.
- ^ Klemm, Dieter; Heublein, Brigitte; Fink, Hans-Peter; Bohn, Andreas (2005). „Cellulose: Fascinating Biopolymer and Sustainable Raw Material”. Angew. Chem. Int. Ed. 44 (22): 3358—93. PMID 15861454. doi:10.1002/anie.200460587.
- ^ Cellulose. (2008). In Encyclopædia Britannica. Retrieved January 11, 2008, from Encyclopædia Britannica Online.
- ^ Chemical Composition of Wood Архивирано 2018-10-13 на сајту Wayback Machine. ipst.gatech.edu.
- ^ Piotrowski, Stephan and Carus, Michael (May 2011) Multi-criteria evaluation of lignocellulosic niche crops for use in biorefinery processes Архивирано на сајту Wayback Machine (3. април 2021). nova-Institut GmbH, Hürth, Germany.
- ^ celuloza, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.
- ^ Payen, A. (1838) "Mémoire sur la composition du tissu propre des plantes et du ligneux" (Memoir on the composition of the tissue of plants and of woody [material]), Comptes rendus, vol. 7, pp. 1052–1056. Payen added appendices to this paper on December 24, 1838 (see: Comptes rendus, vol. 8, p. 169 (1839)) and on February 4, 1839 (see: Comptes rendus, vol. 9, p. 149 (1839)). A committee of the French Academy of Sciences reviewed Payen's findings in : Jean-Baptiste Dumas (1839) "Rapport sur un mémoire de M. Payen, relatif à la composition de la matière ligneuse" (Report on a memoir of Mr. Payen, regarding the composition of woody matter), Comptes rendus, vol. 8, pp. 51–53. In this report, the word "cellulose" is coined and author points out the similarity between the empirical formula of cellulose and that of "dextrine" (starch). The above articles are reprinted in: Brongniart and Guillemin, eds., Annales des sciences naturelles ..., 2nd series, vol. 11 (Paris, France: Crochard et Cie., 1839), pp. 21–31.
- ^ Young, Raymond (1986). Cellulose structure modification and hydrolysis. New York: Wiley. ISBN 978-0-471-82761-0.
- ^ Kobayashi, Shiro; Kashiwa, Keita; Shimada, Junji; Kawasaki, Tatsuya; Shoda, Shin-ichiro (1992). „Enzymatic polymerization: The first in vitro synthesis of cellulose via nonbiosynthetic path catalyzed by cellulase”. Makromolekulare Chemie. Macromolecular Symposia. 54–55 (1): 509—518. doi:10.1002/masy.19920540138.
- ^ Bishop, Charles A., ур. (2007). Vacuum deposition onto webs, films, and foils. Elsevier Science. стр. 165. ISBN 978-0-8155-1535-7.
- ^ Dauenhauer, Paul; Krumm, Christoph; Pfaendtner, Jim (2016). „Millisecond Pulsed Films Unify the Mechanisms of Cellulose Fragmentation”. Chemistry of Materials. 28 (1): 0001. OSTI 1865816. doi:10.1021/acs.chemmater.6b00580.
- ^ Wymer, Charles E. (1994). „Ethanol from lignocellulosic biomass: Technology, economics, and opportunities”. Bioresource Technology. 50 (1): 5. doi:10.1016/0960-8524(94)90214-3.
- ^ Bidhendi, Amir J; Geitmann, Anja (јануар 2016). „Relating the mechanical properties of the primary plant cell wall.” (PDF). Journal of Experimental Botany. 67 (2): 449—461. PMID 26689854. doi:10.1093/jxb/erv535 . Архивирано (PDF) из оригинала 2018-01-13. г.
- ^ Bidhendi, AJ; Chebli, Y; Geitmann, A (мај 2020). „Fluorescence Visualization of Cellulose and Pectin in the Primary Plant Cell Wall”. Journal of Microscopy. 278 (3): 164—181. PMID 32270489. S2CID 215619998. doi:10.1111/jmi.12895.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
Спољашње везе уреди
- Structure and morphology of cellulose by Serge Pérez and William Mackie, CERMAV-CNRS
- Cellulose, by Martin Chaplin, London South Bank University
- Clear description of a cellulose assay method at the Cotton Fiber Biosciences unit of the USDA.
- „Cellulose”. Encyclopædia Britannica (на језику: енглески). 5 (11 изд.). 1911.
- Cellulose films could provide flapping wings and cheap artificial muscles for robots – TechnologyReview.com
