Metod radioaktivnog ugljenika
Metod radioaktivnog ugljenika (engl. radioactive carbon method)[a] metod je koji se koristi prilikom određivanja starosti organskih tvari na temelju omjera broja atoma stabilnog ugljenikovog izotopa 12C i radioaktivnog izotopa 14C.
Izotop 14C nastaje u visokim slojevima Zemljine atmosfere, delovanjem kosmičkih zraka na azot (14N). On se, vezan u ugljenik(IV)-oksid (CO2), širi brzo i ravnomerno celom biosferom. Njegova se količina u atmosferi nije menjala kroz dugo vremensko razdoblje; zapravo, bila je konstantna sve do 1950-ih, kada je testiranjem termonuklearnog oružja u velikim količinama bio proizveden i raspršen u spoljnu sredinu. Iz atmosfere, 14C prelazi direktno u biljke i indirektno, preko lanca ishrane, u druge žive organizme. Zbog toga je u živim bićima omer 12C i 14C konstantan. Kada se smrću prekine izmena tvari između organizma i atmosfere, radioaktivni raspad se ne zaustavlja i organska tvar počinje da gubi 14C. Određivanjem preostalog 14C u nekom uzorku nežive tvari može se izračunati koliko je vremena prošlo od trenutka smrti.
Vreme poluraspada ugljenika 14C iznosi oko 5.730 godina. Ustanovi li se, na primer, da neki komad drveta ili drvenog ugljena sadrži upola manje ugljenika 14C nego živo stablo, zaključuje se da je taj komad drveta ili ugljena star oko 5.730 godina; ako sadrži samo četvrtinu količine 14C koju je imao dok je drvo bilo živo, star je oko 11.460 godina i sl.
Gajger-Milerovim brojačem mogu se odrediti i ekstremno male količine tog izotopa. U živom drvetu, od jednog biliona atoma ugljenika samo je jedan radioaktivan, a u jednom gramu svežeg uzorka ugljenika desi se približno 13,5 raspada u minuti.
Danas se ovom metodom može odrediti starost organskih tvari: pergamenta, odeće, fosila, ljudskih i životinjskih kostiju i dr., od 500 do 50.000 godina unazad. Postupak se primenjuje u arheologiji, antropologiji, geologiji, geofizici itd.[1]
Datiranje ugljenikom-14 razvio je Vilard Libi 1949. godine kao profesor na Univerzitetu u Čikagu. Za to je dobio Nobelovu nagradu za hemiju 1960. godine.[2][3]
Fizičke osnove
urediU prirodi, ugljenik se može naći u obliku dva stabilna, neradioaktivna izotopa. Prvi je ugljenik-12 (12
C) sa zastupljenošću od ≈ 99%, a drugi ugljenik-13 (13
C) sa zastupljenošću od ≈ 1%. Ugljenik se može naći i kao jedan nestabilan, radioaktivni izotop. Reč je o ugljeniku-14 (14
C), kojeg ima samo u tragovima (1 deo na 1×1012 delova ili 0,000 000 000 1%), takođe poznatom i kao „radiougljenik”. Poluživot za 14
C (vreme koje je potrebno da se polovina date količine 14
C raspadne, vreme poluraspada) iznosi (5.730 ± 40) godina, tako da može da se očekuje da će koncentracija ovog izotopa u sledećih nekoliko hiljada godina da opadne. Raspada se u azot-14 preko beta raspada. Aktivnost je oko 14 raspada u minuti po gramu ugljenika-14.
Međutim, 14
C se konstantno proizvodi u donjim slojevima stratosfere i gornjim slojevima troposfere, na visinama 9 km do 15 km iznad površine Zemlje, i to zbog kosmičkog zračenja. Naime, ugljenik-14 oksidira u 14CO2 i raspoređuje se po celoj atmosferi. Omer koncentracija izotopa ugljika 12C : 13C : 14C iznosi 1012 : 1010 : 1. Od ovih izotopa, jedino je ugljenik-14 radioaktivan, pa se njegove nuklide raspadaju prema reakciji prikazanoj ispod. Dakle, nastaju neutroni koji pri pogađanju atoma azota-14 (14
N) usput stvaraju i izotop ugljenika 14
C.[4] Sledećom nuklearnom reakcijom nastaje izotop 14
C:
gde predstavlja neutron, a predstavlja proton.[5]
Kada se proizvede ovim putem, 14
C se veoma brzo spaja sa kiseonikom iz atmosfere da bi nastao ugljen-dioksid (CO
2). Ugljen-dioksid koji je nastao na ovaj način difuzira se u atmosferi, rastvara uokeanu, a biljke ga primaju preko procesa fotosinteze. Životinje jedu biljke, a na kraju se prateći lanac ishrane radiougljenik distribuiše kroz celu biosferu. Odnos 14
C naspram 12
C je oko 1,5 delova 14
C na 1012 delova 12
C.[6] Dodatno, oko 1% atoma ugljenika potiče od stabilnog izotopa 13
C.[4]
Jednačina radioaktivnog raspada 14
C je:[7]
Emitujući jednu beta česticu (elektron, ) i jedan elektronski antineutrino ( ), jedan od neutrona u jezgru 14
C menja se u proton i jezgro 14
C se pretvara nazad u stabilni (neradioaktivni) izotop 14
N.[8]
Faktori koji utiču na tačnost proračuna starosti uzorka
urediStabilni atom azota-14 je stvoren, elektron i antineutrino. Nekoliko faktora utiče na tačnost:
- proces izotopne izmene tj. frakcionisanje ugljenikovih atoma
- varijacije koncentracije ugljenika-14 u atmosferi u prošlosti
- kontaminacija/zagađivanje uzoraka savremenim ili starim ugljenikom-14
Izotopsko frakcionisanje
uredi| Materijal | Tipični interval (≈) za δ13 C |
|---|---|
| PDB | 0 ‰ * |
| Morski plankton | [−22 ‰, −17 ‰][9] |
| C3 biljke | [−30 ‰, −22 ‰][9] |
| C4 biljke | [−15 ‰, −9 ‰][9] |
| Atmosferski CO 2 |
−8 ‰ *[10] |
| Morski CO 2 |
[−32 ‰, −13 ‰][9] |
Fotosinteza je primarni proces posredstvom kojeg ugljenik dolazi iz atmosfere u živa bića. Na fotosintetičkim putanjama, 12
C se apsorbuje nešto lakše nego 13
C, koji je se opet lakše apsobuje od 14
C. Razlika u unosu ovih triju izotopa vodi do stvaranja različitih odnosa 13
C : 12
C i 14
C : 12
C u biljkama u odnosu na te odnose zastupljene u atmosferi. Ovaj efekat je poznat kao izotopsko frakcionisanje.[9][10]
Da bi se odredio stepen frakcionisanja koji se dešava u određenoj biljci, mere se količine i izotopa 12
C i izotopa 13
C, a rezultujuća razmera 13
C : 12
C se poredi sa standardnim odnosom, poznatim pod engleskom skraćenicom PDB (engl. Pee Dee Belemnite — „pi-di-belemnit”, fosil iz Pi Di formacije u Južnoj Karolini).[11] Proporcija 13
C : 12
C se koristi umesto 14
C : 12
C zato što je mnogo lakša za izmeriti, a ova druga može da se izvede od. izračuna bez problema ako je prva poznata: relativno trošenje 13
C u odnosu na 12
C je proporcionalno razlici u atomskim masama dvaju izotopa, tako da je trošenje 14
C jednako dvostrukom trošenju 13
C.[12] Frakcionisanje za 13
C, poznato i kao δ13
C, računa se po sledećoj formuli:[10]
gde (znak za promil, ‰) označava „delove od hiljadu”.[10] Pošto PDB standard sadržava neobično velike proporcije 13
C (PDB vrednost iznosi 11,2372 ‰)[13] većina izmerenih vrednosti za δ13
C je negativna, što nije greška.
C od obične trave, a uzorci koji su uzeti od ovih životinja merili su vrednosti za δ13
C i do ≈ −13 ‰, što je mnogo više od vrednosti za ovce koje se hrane običnom travom[10]
Osnovni princip proračuna starosti uzorka
urediŽive biljke iz atmosfere uzimaju ugljenik-14 14
C, kao i ugljenik-12 12
C i ugrađuju ih u šećere, životinje jedu biljke i u njih se prenosi isti odnos ugljenika-14 14
C i ugljenika-12 12
C kakav je postojao u atmosferi Zemlje u vreme tog hranjenja.[14]
Kada biljka, ili životinja umre, ona prestaje da stiče 14
C, ali 14
C unutar njenog biološkog materijala u tom momentu će nastaviti da se raspada. Dakle, odnos 14
C i 12
C u ostacima će postepeno da se smanjuje.
Pošto je brzina kojom se 14
C raspada poznata, postotak radiougljenika može da se iskoristi da bi se odredio vremenski period koji je prošao od momenta kada je dati uzorak prestao da razmenjuje ugljenik sa okolinom — što je uzorak stariji, manje 14
C će se da ostaje u njemu.[6]
Jednačina koja upravlja raspadom radioaktivnog izotopa je:[4]
gde je — broj atoma izotopa u originalnom uzorku (u trenutku , kada je organizam čiji se uzorak ispituje umro), broja preostalih atoma posle vremena ,[4] a konstanta koja zavisi od određenog izotopa (za dati izotop ona je jednaka recipročnoj vrednosti srednjeg života — prosečnog ili očekivanog vremena koje će dati atom da preživi pre nego što bude podvrgnut procesu radioaktnivnog raspada)[4]
Srednji život, koji se označava sa , za 14
C iznosi oko 8.267 godina, tako da jednačina iznad može da se prepiše u sledećem obliku:[15]
gde je dato u godinama.
Podrazumeva se da uzorak mora da originalno ima isti odnos 14
C : 12
C kao što ga ima atmosfera, a pošto je veličina uzorka poznata, ukupan broj atoma u uzroku može da se izračuna, dajući — broj atoma 14
C u originalnom uzorku (u momentu kada je organizam umro). Merenje vrednosti za — trenutni broj atoma 14
C u uzorku, omogućava izračunavanje vremena — starost uzorka, a sve koristeći jednačinu prikazanu iznad.[6]
Poluživot radioaktivnog izotopa (koji se obično označava sa ) je mnogo češće korišćen koncept od srednjeg života. Iako jednačine predstavljene iznad u obzir uzimaju samo srednji život, više je uobičajena upotreba vrednosti poluživota za izotop 14
C nego njegovog srednjeg života. Srednji život i poluživot su povezani sledećom jednačinom:[4]
Trenutno prihvaćena vrednost za poluživot 14
C je 5.730 godina.[4] Ovo znači, kao što je već pomenuto, da će nakon 5.730 godina samo polovina početnog 14
C da preostane u uzorku; nakon 11.460 godina će da preostane četvrtina početnog 14
C; nakon 17.190 godina će da preostane osmina početnog 14
C i tako dalje.
Detaljniji proračun starosti uzorka
urediRadioaktivni raspad izotopa ugljenika-14 sledi eksponencijalni raspad:
gde je: — broj radioaktivnih atoma ugljenika-14; — konstanta raspada (pozitivan broj).
Kao rešenje ove jednačine, broj radioaktivnih atoma se može napisati kao funkcija vremena:
Funkcija opisuje eksponencijalno raspadanje u vremenskom rasponu , a kao početni uslov dato je — broj atoma ugljenika-14 na početku raspadanja, kada je .
Dva relativna vremena se mogu definisati prema navedenome:
- srednji život (srednje vreme koje svaki radioaktivni atom provede u datom uzorku dok se ne raspadne)
- = /ugljenik-14 srednji ili prosečni život (8.033 godine; Libi vrednost)/
- poluživot (vreme koje je prošlo za pola broja radioaktivnih atoma da se raspadnu u datom uzorku)
- = /ugljenik-14 poluživot (5.568 godina; Libi vrednost)/
Prema tome, za radioaktivni datum sledi:
S druge strane, za radioaktivno doba važi negativna vrednost radioaktivnog datuma:
Nakon zamene vrednosti, za teoretsko radioaktivno doba — dobijeno koristeći logaritam za prirodni broj (broj е) — vredi sledeća formula:
Koristeći logaritam sa bazom 2, vreme poluživota je:
Metode merenja
urediGeneralno, u upotrebi su tri osnovne tehnike merenja aktivnosti izotopa ugljika-14 u raznim materijalima:
- merenje gasnim proporcionalnim brojačem
- merenje tekućinskim scinitilacijskim brojačem
- merenje akceleratorskom masenom spektroskopijom
Osnovna karakteristika svih ovih metoda je da su destruktivne, tj. uzorak čiju se starost želi odrediti treba spaliti i dalje pripremiti u obliku pogodnom za merenje aktivnosti ugljenika-14.
Radiometrijske metode se zasnivaju na brojanju pojedinačnih raspada radioaktivnog izotopa ugljenika-14. Potrebna količina ugljenika ovisi o veličini i tipu brojača, ali nije manja od 5 g, s tim da valja uzeti u obzir činjenicu da ugljenik čini oko trećinu mase organskog materijala. Za datiranje kostiju treba uzeti daleko veću količinu uzorka, jer iz njih treba ekstrahirati organski dio (kolagen), čiji se udio smanjuje kod starih kostiju.
Poseban problem radiometrijskih merenja predstavlja uticaj zračenja okoline i kosmičkog zračenja, koji zasenjuje detekciju radioaktivnog raspada atoma ugljenika-14. Ovo tzv. osnovno zračenje potrebno je redukovati što je više moguće, primenom tzv. pasivnih i aktivnih štitova. Pasivni štit se sastoji od velike količine olova koje redukuje utiecaj kosmičkih zraka, odnosno parafina koji smanjuje utiecaj neutronskog zračenja. U cilju smanjenja utiecaja kosmičkog zračenja, laboratorije se obično smeštaju u suterenske ili podrumske prostorije. Aktivni štit se sastoji od dodatnih detektora koji registruju prolaz kosmičkog zračenja i koji rade u tzv. antikoincidentnoj tehnici.
Ako oba detektora (onaj koji meri aktivnost ugljenika-14 u uzorku i ovaj zaštitni) istovremeno detektuju neki impuls, onda to znači da on potieče od osnovnog zračenja, a ne od raspada atoma ugljenika-14, pa se takvi impulsi odbacuju.
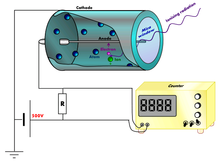
Gasni proporcionalni brojač
urediKod merenja aktivnosti ugljenika-14 gasnim proporcionalnim brojačem (engl. gas proportional counter, GPC), potrebno je određenim hemijskim postupcima dobiti neki gas koji sadrži sav ugljenik iz uzorka, a istovremeno se može koristiti kao radni gas u brojaču. Zavisno o laboratoriji, kao brojački gas upotrebljavaju se ugljen-dioksid, metan, acetilen ili benzen. Proporcionalni brojač se sastoji obično od cilindrične katode i anode u obliku tanke centralne žice. Između njih razlika potencijala iznosi nekoliko hiljada volti. Beta čestice nastale raspadom ugljenika koji je sastavni deo molekula brojačkog gasa, joniziraju na svom putu molekule gasa, ostavljajući za sobom trag koji se sastoji od pozitivnih jona i elektrona. Elektroni se ubrzavaju prema anodi te u njenoj blizini — gde je električno polje najjače — proizvode lavine parova „jon — elektron” koji se sakupljaju na anodi, dalje proizvodeći električne impulse. Svaki beta raspad stvori jedan impuls i isti se detektuje elektroničkim putem.
Tekućinski scintilacijski brojač
urediKod merenja aktivnosti ugljenika-14 tekućinskim scintilacijskim brojačem (engl. liquid scintillation counter, LSC), uzorak se hemijskim postupcima pretvara u benzen (C6H6), koji je veoma pogodan materijal budući da je 96% njegovog sastava ugljenik. Scintilacijski detektori zasnivaju svoj rad na činjenici da čestice jonizacijskog zračenja — usporavajući se ili zaustavljajući se u određenim organskim spojevima nazvanim scintilatori — uzrokuju pulseve svetlosnih fotona. Stoga se benzenu dodaje manja količina organskog scintilatora, kako bi se dobio scintilacijski rastvor, tzv. koktel. Budući da je ugljenik-14 sastavni dio uzorka, elektroni nastali beta raspadom ekscitiraju njegove molekule. Ekscitacijska energija se prenosi od jedne molekule do druge, sve dok je ne zarobi molekula scintilatora, prilikom čega se emituje svetlo (foton). Broj emitovanih fotona proporcionalan je energiji jonizacije. Dobijeni svetlosni fotoni se na foto-katodi pretvaraju u elektrone (fotoelektrični efekat). Fotomultiplikator ubrzava primarne elektrone s foto-katode i pri tom se njihov broj umnožava. Na izlazu se dobija snažan električni puls proporcionalan amplitudi svetla (scintilacija) od. energiji upadne čestice.
Akceleratorska masena spektroskopija
urediKod merenja aktivnosti ugljenika-14 akceleratorskom masenom spektroskopijom/spektrometrijom (engl. accelerator mass spectrometry, AMS), nasuprot radiometrijskim tehnikama, ovde se umesto pojedinačnih raspada atoma ugljenika-14 meri omer atoma izotopa ugljenika-14 u odnosu na najzastupljeniji izotop ugljenika, ugljenik-12. Kod ove tehnike na brojanje ne utiče kosmičko zračenje koje je glavni izvor smetnji kod gasnih i tekućinskih brojača. Akceleratorskom tehnikom se može odrediti starost daleko manje količine uzorka, sve do miligrama ili čak mikrograma (npr. zrno žita, komadić tkanine, deo lista papira); granična starost koja se može izmeriti ovom metodom iznosi do približno 60.000 godina. Dodatne prednosti ove metode su kratko vreme merenja i manja mogućnost pogreške, s tim da je ona daleko skuplja i zahteva rad na skupim nuklearnim mašinama. Uzorak se hemijskim putem prevodi u grafit, koji predstavlja metu koja se izlaže bombardiranju česticama iz akceleratora. Jonizirani atomi se zatim ubrzavaju u jakom električnom polju. Prolaskom kroz magnet, razdvajaju se atomi 14C od atoma 12C i 13C, nakon čega se u posebno konstruisanom detektoru određuje omer 14C : 12C za svaki uzorak.[19]
Kalibracija
urediStarost merena metodom radioaktivnog ugljenika temelji se na pretpostavci da je koncentracija aktivnosti ugljenika-14 u prirodnim rezervoarima (prvenstveno atmosferi) u prošlosti bila konstantna. Međutim, ponajviše usled flukutacija Sunčevog magnetskog polja (Sunčev ciklus), ona nije bila konstantna; prema tome, rezultati merenja ne odgovaraju apsolutno pravoj starosti materijala čija se starost određuje.[21] Zbog toga se ukazala potreba da se promene u koncentraciji aktivnosti ugljenika-14 u prošlosti odrede nekom nezavisnom metodom. Cikličke promene godišnjih doba uzrokuju nepravilnosti u širini godova u drveću, a one su slične za sve drveće iste vrste u određenoj klimatskoj zoni. Sled godova stvara time vrstu kalendara. Spajanjem sleda godova pojedinog starog drveta poznate starosti i merenjem aktivnosti ugljenika-14 kod pojedinačnih godova, bilo je moguće dobiti neprekinutu kalibracijsku krivulju za proteklih čak 12.000 godina.
Produžavanje kalibracijske krivulje na još veće starosti moguće je metodom brojanja varvi (godišnji sloj sedimentnih stena), te datiranjem siga (stalaktiti, stalagmiti) ili sedri metodom torijum-230 / uranijum-234 / uranijum-238.
Stvaranje ugljenika-14 za vreme nuklearnih eksperimenata
urediNadzemni nuklearni eksperimenti koji su izvođeni u nekoliko država između 1955. i 1980, znatno su povećali količinu ugljenika-14 u atmosferi, a automatski i u celoj biosferi. Nakon toga se količina ugljenika-14 počela smanjivati.[22]
Vidi još
urediNapomene
urediReference
uredi- ^ „Radioizotopno datiranje” (2014). enciklopedija.hr. Hrvatska enciklopedija. Leksikografski zavod Miroslav Krleža.
- ^ Arnold, J. R.; Libby, W. F. (1949). „Age Determinations by Radiocarbon Content: Checks with Samples of Known Age”. Science. 110 (2869): 678—680. PMID 15407879. doi:10.1126/science.110.2869.678. Arhivirano iz originala 15. 01. 2019. g. Pristupljeno 28. 12. 2015.
- ^ Willard Frank Libby
- ^ a b v g d đ e Bowman 1995, str. 9–15
- ^ Bianchi & Canuel (2011). str. 35.
- ^ a b v Aitken 1990, str. 56–58
- ^ Currie, Lloyd A. (2004). „The remarkable metrological history of radiocarbon dating II”. Journal of Research of the National Institute of Standards and Technology. 109: 185—217. doi:10.6028/jres.109.013.
- ^ Taylor & Bar-Yosef (2014). str. 33.
- ^ a b v g d Maslin & Swann (2006). str. 246.
- ^ a b v g d Bowman 1995, str. 20–23
- ^ Taylor & Bar-Yosef (2014). str. 125.
- ^ Aitken 1990, str. 61–66
- ^ Dass 2007, str. 276.
- ^ Logos 2017, str. 307-308.
- ^ Aitken 1990, str. 59.
- ^ „Atmospheric δ14C record from Wellington”. Trends: A Compendium of Data on Global Change. Carbon Dioxide Information Analysis Center. Oak Ridge National Laboratory. 1994. Arhivirano iz originala 01. 02. 2014. g. Pristupljeno 16. 10. 2016.
- ^ Levin, I.; et al. (1994). „δ14C record from Vermunt”. Trends: A Compendium of Data on Global Change. Carbon Dioxide Information Analysis Center. Arhivirano iz originala 23. 09. 2008. g. Pristupljeno 16. 10. 2016.
- ^ „Radiocarbon dating”. University of Utrecht. Pristupljeno 16. 10. 2016.
- ^ Taylor, R. E.; Southon, J. (2007). „Use of natural diamonds to monitor chem 14C – AMS instrument backgrounds”. Nuclear Instruments and Methods in Physics Research B. 259: 282—328. doi:10.1016/j.nimb.2007.01.239.
- ^ Stuiver, M.; Reimer, P. J.; Braziunas, T. F. (1998). „High-precision radiocarbon age calibration for terrestrial and marine samples”. Radiocarbon. 40: 1127—1151. Arhivirano iz originala 29. 05. 2010. g. Pristupljeno 28. 12. 2015.
- ^ Kudela, K.; Bobik, P. (2004). „Long-Term Variations of Geomagnetic Rigidity Cutoffs”. Solar Physics. 224: 423—431. doi:10.1007/s11207-005-6498-9.
- ^ Reimer, Paula J.; Brown, Thomas A.; Reimer, Ron W. (2004). „Discussion: Reporting and Calibration of Post-Bomb chem 14C – Data”. Radiocarbon. 46 (3): 1299—1304.
Literatura
uredi- Aitken, M.J. (1990). Science-based Dating in Archaeology. London: Longman. ISBN 0-582-49309-9.
- Aitken, Martin J. (2003). „Radiocarbon Dating”. Ur.: Ellis, Linda. Archaeological Method and Theory. New York: Garland Publishing. str. 505—508.
- Bianchi, Thomas S.; Canuel, Elizabeth A. (2011). Chemical Markers in Aquatic Ecosystems. Princeton: Princeton University Press. ISBN 978-0-691-13414-7.
- Bousman, C. Britt; Vierra, Bradley J. (2012). „Chronology, Environmental Setting, and Views of the Terminal Pleistocene and Early Holocene Cultural Transitions in North America”. Ur.: Bousman, C. Britt; Vierra, Bradley J. From the Pleistocene to the Holocene: Human Organization and Cultural Transformations in Prehistoric North America. College Station, Texas: Texas A&M University Press. str. 1—15. ISBN 978-1-60344-760-7.
- Bowman, Sheridan (1995) [1990]. Radiocarbon Dating. London: British Museum Press. ISBN 0-7141-2047-2.
- Cronin, Thomas M. (2010). Paleoclimates: Understanding Climate Change Past and Present. New York: Columbia University Press. ISBN 978-0-231-14494-0.
- Dass, Chhabil (2007). Fundamentals of Contemporary Mass Spectrometry. Hoboken, New Jersey: John Wiley & Sons. ISBN 978-0-471-68229-5.
- Eriksson Stenström, Kristina; Skog, Göran; Georgiadou, Elisavet; Genberg, Johan; Johansson, Anette (2011). A guide to radiocarbon units and calculations. Lund: Lund University.
- Ferronsky, V.I.; Polyakov, V.A. (2012). Isotopes of the Earth's Hydrosphere. New York: Springer. ISBN 978-94-007-2855-4.
- Killick, David (2014). „Using evidence from natural sciences in archaeology”. Ur.: Chapman, Robert; Alison, Wylie. Material Evidence: Learning From Archaeological Practice. Abingdon, UK: Routledge. str. 159—172. ISBN 978-0-415-83745-3.
- L'Annunziata, Michael F. (2007). Radioactivity: Introduction and History. Amsterdam: Elsevier. ISBN 978-0-444-52715-8.
- L'Annunziata, Michael F.; Kessler, Michael J. (2012). „Liquid scintillation analysis: principles and practice”. Ur.: L'Annunziata, Michael F. Handbook of Radioactivity Analysis (III izd.). Oxford: Academic Press. str. 423—573. ISBN 978-0-12-384873-4.
- Libby, Willard F. (1965) [1952]. Radiocarbon Dating (II (1955) izd.). Chicago: Phoenix.
- Macdougall, Doug (2008). Nature's Clocks: How Scientists Measure the Age of Almost Everything. Berkeley, California: University of California Press. ISBN 978-0-520-24975-2.
- Malainey, Mary E. (2010). A Consumer's Guide to Archaeological Science. New York: Springer. ISBN 978-1-4419-5704-7.
- Maslin, Mark A.; Swann, George E.A. (2006). „Isotopes in marine sediments”. Ur.: Leng, Melanie J. Isotopes in Palaeoenvironmental Research. Dordrecht: Springer. str. 227—290. ISBN 978-1-4020-2503-7.
- Mook, W.G.; Waterbolk, H.T. (1985). Handbooks for Archaeologists: No. 3: Radiocarbon Dating. Strasbourg: European Science Foundation. ISBN 2-903148-44-9.
- Post, Wilfred M. (2001). „Carbon cycle”. Ur.: Goudie, Andrew; Cuff, David J. Encyclopedia of Global Change: Environmental Change and Human Society, Volume 1. Oxford: Oxford University Press. str. 127—130. ISBN 0-19-514518-6.
- Renfrew, Colin (2014). „Foreword”. Ur.: Taylor, R.E.; Bar-Yosef, Ofer. Radiocarbon Dating. Walnut Creek, California: Left Coast Press. str. 12—14. ISBN 978-1-59874-590-0.
- Schoeninger, Margaret J. (2010). „Diet reconstruction and ecology using stable isotope ratios”. Ur.: Larsen, Clark Spencer. A Companion to Biological Anthropology. Oxford: Blackwell. str. 445—464. ISBN 978-1-4051-8900-2.
- Šilar, Jan (2004). „Application of environmental radionuclides in radiochronology: Radiocarbon”. Ur.: Tykva, Richard; Berg, Dieter. Man-made and Natural Radioactivity in Environmental Pollution and Radiochronology. Dordrecht: Kluwer Academic Publishers. str. 150—179. ISBN 1-4020-1860-6.
- Suess, H.E. (1970). „Bristlecone-pine calibration of the radiocarbon time-scale 5200 B.C. to the present”. Ur.: Olsson, Ingrid U. Radiocarbon Variations and Absolute Chronology. New York: John Wiley & Sons. str. 303—311.
- Taylor, R.E. (1987). Radiocarbon Dating. London: Academic Press. ISBN 0-12-433663-9.
- Taylor, R.E. (1997). „Radiocarbon dating”. Ur.: Taylor, R.E.; Aitken, Martin J. Chronometric Dating in Archaeology. New York: Plenum Press. str. 65—97. ISBN 0-306-45715-6.
- Taylor, R.E.; Bar-Yosef, Ofer (2014). Radiocarbon Dating (2nd izd.). Walnut Creek, California: Left Coast Press. ISBN 978-1-59874-590-0.
- Terasmae, J. (1984). „Radiocarbon dating: some problems and potential developments”. Ur.: Mahaney, W.C. Quaternary Dating Methods. Amsterdam: Elsevier. str. 1—15. ISBN 0-444-42392-3.
- Theodórsson, Páll (1996). Measurement of Weak Radioactivity. Singapore: World Scientific Publishing. ISBN 9810223153.
- Trumbore, Susan E. (1996). „Applications of accelerator mass spectrometry to soil science”. Ur.: Boutton, Thomas W.; Yamasaki, Shin-ichi. Mass Spectrometry of Soils. New York: Marcel Dekker. str. 311—340. ISBN 0-8247-9699-3.
- Tuniz, C.; Zoppi, U.; Barbetti, M. (2004). „Radionuclide dating in archaeology by accelerator mass spectrometry”. Ur.: Martini, M.; Milazzo, M.; Piacentini, M. Physics Methods in Archaeometry. Amsterdam: IOS Press. str. 385—405. ISBN 978-1-58603-424-5.
- Walker, Mike (2005). Quaternary Dating Methods (PDF). Chichester: John Wiley & Sons. ISBN 978-0-470-86927-7. Arhivirano iz originala (PDF) 14. 07. 2014. g. Pristupljeno 16. 10. 2016.
- Warneck, Peter (2000). Chemistry of the Natural Atmosphere. London: Academic Press. ISBN 0-12-735632-0.
- Logos, Aleksandar A. (2017). Putovanje misli : uvod u potragu za istinom. Beograd.
Spoljašnje veze
uredi- (jezik: engleski) RADON – baza podataka za evropske 14C datume
- (jezik: hrvatski) Određivanje starosti tvari metodom 14C — Institut Ruđer Bošković
- (jezik: hrvatski) Upotreba fizičkih metoda u arheologiji (Marko Sever)