Hemijsko jedinjenje
Hemijsko jedinjenje je čista hemijska supstanca koja se sastoji iz dva ili više različitih hemijskih elemenata,[1][2][3] a koja se pomoću hemijskih reakcija može razdvojiti u jednostavnije supstance.[4] Svako hemijsko jedinjenje ima jedinstvenu, definisanu hemijsku strukturu. Ona se sastoje od atoma u fiksnom odsnosu[3] koji su povezani jedan s drugim hemijskim vezama u definisanom prostornom rasporedu. Hemijska jedinjenja mogu biti molekuli koji su povezani kovalentnim vezama, soli koje su nastale vezanjem atoma jonskim vezama, međumetalna jedinjenja koji se drže na okupu metalnim vezama ili kompleksi koji su povezani koordinatnim kovalentnim vezama. Razlika između hemijskog jedinjenja i smese ogleda se u tome što se smesa može rastaviti na svoje pojedinačne sastojke fizičkim metodama razdvajanja (separacije), poput filtriranja, sedimentacije, destilacije i drugih.
 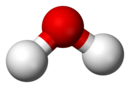 | |
| Na gornjoj slici: čista voda (H2O) u čaši, primer je hemijskog jedinjenja. Dole: takozvani molekulski model "lopte i štapa" koji predstavlja da je sastavljena voda iz dva dela vodonika (prikazan belo) i jednog dela kiseonika (crveno) |
Čisti hemijski elementi se ne smatraju hemijskim jedinjenjima, čak i kada su oni sastavljeni iz molekula koje sadrže samo jednu vrstu atoma jednog elementa (kao na primer molekuli H2, S8, itd.),[5] a koji se nazivaju diatomnim ili poliatomnim molekulima.
Šire definicije
urediPostoje određeni izuzeci od gornje definicije, jer mnogi čvrsti hemijski materijali koji su izobilni na Zemlji (na primer mnogi silikatni minerali), nemaju jednostavne hemijske formule u kojima su različiti elementi spojeni hemijskim vezama jedan s drugim, drugim rečima oni ne stoje u tačnoj i fiksnoj razmeri. Takva kristalna jedinjenja se nazivaju nestehiometrijskim. Njihov sastav varira bilo zbog prisustva drugih elemenata koji su zarobljeni unutar njihove kristalne strukture bilo da ima manjka ili viška nekog od njihovih osnovnih elemenata. Takva nestehiometrijska hemijska jedinjenja sačinjavaju najveći deo Zemljine kore.
Druga jedinjenja, za koje se smatra da su hemijski identična, mogu imati različite količine težih ili lakših izotopa svojih sastavnih elemenata, a koji neznatno menjaju maseni odnos elemenata.
Brojnost i raznovrsnost
urediU zavisnosti od načina i vrste veze između atomima elemenata od kojih se sastoji dato jedinjenje, mogu se razlikovati četiri osnovne vrste hemijskih jedinjenja:
- kovalentna jedinjenja (jedinjenja jednog nemetalnog elementa i jednog ili više drugih nemetala)
- jonska jedinjenja (sastoje se od jednog metala i jednog ili više nemetala)
- metalna jedinjenja
- kompleksi (kompleksna jedinjenja, od katjona metala i jona ili drugih molekula)
Tačnija, preciznija kategorizacija molekula i njihova sistematizacija u neku od ova četiri kategorije može se načiniti pomoću razlika u elektronegativnosti elemenata koji ulaze u sastav nekog jedinjenja. Međutim, postoje i određeni prelazni oblici između četiri navedena idealna tipa jedinjenja.
Danas je poznato više od 80 miliona poznatih hemijskih jedinjenja, jonskih, tj. jedinjenja sličnih solima kao i kompleksa, metalnih i molekularnih jedinjenja. Takođe jedna od osnovnih podela je podela na neorganska i organska jedinjenja, pri čemu se kao organska, uz samo nekoliko izuzetaka, označavaju sva jedinjenja koji sadrže ugljenik. Godine 2002. bilo je poznato oko 16 miliona organskih, tri miliona neorganskih jedinjenja i oko jedan milion polimera.[6]
Kovalentna jedinjenja
urediJedinjenja nastaju od dva ili više atoma nemetala. Oni su u opštem slučaju izolatori, ne provode električnu struju, i uglavnom imaju relativno nisku tačku ključanja (osim jedinjenja sličnih dijamantu i veštačkih materijala sa izuzetno velikim molekulima). Najmanji delovi kovalentno vezanih jedinjenja su neutralni spojevi atoma (molekuli). Oni se mogu sastojati iz dva atoma (kao na primer ugljen-monoksid, CO), tri atoma (na primer ugljen-dioksid), a neki i do nekoliko hiljada ili desetina hiljada atoma (ogromni molekuli, polimeri, na primer vještački materijal polietilen ili molekul koji prenosi genetski materijal (DNK). Atomi u molekulima su povezani putem atomskih veza, tj. atomi koji su međusobno povezani zajednički koriste parove spoljašnjih elektrona.
Jonska jedinjenja
urediJonska jedinjenja (soli) sastoje se iz katjona i anjona. Oni su često poput soli:
- krti,
- formiraju kristale
- imaju relativno visoku tačku topljenja i ključanja, i
- provode električnu struju samo u smeši ili rastvoru.
Joni nastaju reakcijama atoma metala i nemetala, pri čemu atomi metala otpuštaju elektrone (oksidiraju), a te elektrone primaju atomi nemetala (reduciraju se). Tako nastali katjoni metala i anjoni nemetala se spajaju zbog elektrostatičke privlačnosti kristalnih jona. Prema vrsti nemetala koji formiraju jonske veze razlikuju se sledeća jonska jedinjenja: oksidi (kiseonik kao anjon), sulfidi (sumpor), fluoridi (fluor), hloridi, bromidi, jodidi, nitridi (sa azotom), karbidi (sa ugljenikom), hidridi (sa vodonikom) i drugi. Pored toga, u sastav anjona ulazi i kiseonik kao treći element, pa tako nastaju još i sulfati, hlorati, nitrati, karbonati itd.
Neki od primera jonskih jedinjenja su gvožđe(III) oksid (slično rđi), pirit (gvožđe-sulfid), natrijum hlorid (kuhinjska so) i kalcijum sulfat (gips).
Međumetalna jedinjenja
urediMeđumetalna jedinjenja (često u svakodnevnom govoru poznata i kao legure) nastaju iz dva ili više metala. One su:
- vrlo dobri provodnici električne struje,
- dobro se mogu oblikovati,
- imaju metalni sjaj,
- dobro provode toplotu i
- na sobnoj temperaturi su uglavnom u čvrstom stanju.
Spajanje različitih metala u legure može se vršiti u proizvoljnim razmerama, naročito kada se radi o mešanju dva ili više istopljena metala u smesu. Kada se grade međumetalna jedinjenja, tada su elementi koje ih grade sadržani u njima samo u tačno određenim količinskim odnosima (međumetalnim fazama, stehiometrijskim sastavima, vidi takođ i članak stehiometrija)
Primeri legura su bronza (od bakra i kalaja), mesing (bakar sa cinkom) i bakar-nikl (metal za izradu kovanica). Primeri međumetalnih jedinjenja su jedinjenja između magnezijuma i germanijuma (formula: Mg2Ge), Al2Cu, magnezijum silicid (Mg2Si), bronza Cu4Sn, te cementit {{Fe3C}} (od gvožđa i ugljenika, pri čemu se ugljenik ponaša kao metal) i WC (volfram karbid).
Kompleksi
urediJedinjenja višeg reda (kompleksi) nastaju putem reakcije građenja kompleksa, većinom iz katjona obojenih metala i molekula sa slobodnim elektronskim parovima (ligandima). Mnogi od kompleksa su izrazito obojeni raznim bojama.
Na primer, supstanca koja daje crvenu boju krvi, hemoglobin, sastoji se iz jona gvožđa(II) i molekula belančevina, te tamnoplavi kompleks bakar-tetramina sastavljen iz jona bakra(II) i amonijaka.
Organska jedinjenja
urediMolekularna jedinjenja, u kojima je sadržan ugljenik spojen sa vodonikom, označavaju se kao organskim jedinjenjima. Oni sačinjavaju najveći deo svih poznatih hemijskih jedinjenja, a njihova raznovrsnost kreće se od najjednostavnijih poput gasa metana iz grupe alkana, odnosno uopšte ugljovodonika, do vrlo složenih jedinjenja. Pored ugljenikovog skeletona (lanca), u organskim jedinjenjima često se nalaze i mnoge druge atomske grupe, koje u znatnoj meri utiču na osobine organskih jedinjenja.
Prema ugljikovom skeletonu (lancu), organska jedinjenja se mogu podeliti na:
- alifatični ugljovodonici (alifate, između ostalih aciklične ugljovodonike, zasićene alkane, nezasićene alkene i alkine, te ciklične ugljovodonike.
- aromatični ugljovodonici (aromate, koji se dalje dijele na jednostavne i kondenzirane aromate),
- heterociklična jedinjenja, kao i
- biohemijska jedinjenja (alkaloidi, aminokiseline, ugljeni hidrati, belančevine, steroide, terpene, vitamine itd.)
Prema funkcionalnim grupama, organska jedinjenja se mogu podeliti na:
- jedinjenja kiseonika i hidroksi-jedinjenja (alkohole, aldehide, estre, etre, ketone, karboksilne kiseline itd.)
- jedinjenja azota (amine, amide, nitro-jedinjenja, nitrile),
- jedinjenja sumpora (alkantiole, sulfide, disulfide, estre sumporne kiseline, sulfone, sulfokside, tionamide, tioestre, tio kiseline itd.)
- jedinjenja fosfora (fosfate, fosfine),
- organometalna jedinjenja.
Osnovni koncepti
urediKarakteristične osobine jedinjenja su:
- Hemijski elementi se nalaze u jedinjenju u određenoj proporciji
Na primer jedan atom natrijuma i jedan atom hlora postaju jedan molekul natrijum-hlorida (osnovnog sastojka kuhinjske soli)
- Jedinjenja imaju konačan skup osobina
Elementi iz kojih se sastoji neko jedinjenje, ne zadržavaju svoje prvobitne osobine. Na primer, vodonik (zapaljivi gas koji ne podržava sagorevanje) + kiseonik (nezapaljivi gas koji podržava sagorevanje) postaju voda (nezapaljivi molekul koji ne podržava sagorevanje).
Valencija predstavlja broj atoma vodonika koji se mogu spojiti (kombinovati) sa atomom nekog elementa da bi dali (proizveli) neko hemijsko jedinjenje.
Formula
urediHemičari opisuju jedinjenja koristeći hemijske formule u raznim formatima.[10][11][12] Za jedinjenja koja postoje u vidu molekula, koriste se formule za molekularne jedinice. Za polimerne materijale, kao i minerale i mnoge metalne oksine, obično se navodi empirijske formula, npr. NaCl za kuhinjsku so.
Elementi u hemijskoj formuli obično su navedeni po određenom redu, nazvanom Hilov sistem. U tom sistemu, obično su prvo navedeni atomi ugljenika (ako ih ima), zatim se navode atomi vodonika (ako ih ima), te posle njih svi ostali elementi po abecednom redu. Ako formula ne sadrži ugljenik onda se svi elementi, uključujući i vodonik, navode po abecednom redu. Međutim, od tog pravila postoji nekoliko važnih izuzetaka. Za jonska jedinjenja, pozitivni jon se gotovo uvek navodi na prvom mestu, dok se negativni jon navodi nakon njega. Za okside, atomi kiseonika se obično navode na kraju formule.
U opštem slučaju, organske kiseline slede normalna pravila da se C i H atomi navode prvi u formuli. Na primer, formula za trifluoroacetatnu kiselinu obično se piše kao C2HF3O2. Međutim, više strukturnih podataka mogu otkriti opisne formule, kao što je na primer formula za istu kiselinu u obliku CF3CO2H. S druge strane, hemijske formule za većinu neorganskih kiselina i baza su izuzeci od normalnih pravila. One se pišu u skladu sa pravilima za jonska jedinjenja (pozitivni prvi, negativni drugi), ali one takođe slede pravila koja naglašavaju njihove Arenijusove definicije. Tačnije, formula za većinu neorganskih kiselina počinje sa vodonikom, a formula za većinu baza završava sa hidroksidnim jonom (OH-).
Formule za neorganska jedinjenja često ne daju detaljnije strukturne podatke o njima, kao što to ilustrira uobičajena upotreba formule H2SO4 za molekul (sumporne kiseline) koja ne sadrži H-S veze. Prezentacija koja bi dala mnogo više opisa i podataka bila bi O2S(OH)2, ali se gotovo nikad ne piše na ovaj način.
Faze i termalne osobine
urediJedinjenja se takođe, kao i hemijski elementi, mogu pojavljivati u nekoliko agregatnih stanja. Sva jedinjenja se mogu postojati u čvrstom stanju, barem na dovoljno niskim temperaturama. Molekularna jedinjenja takođe mogu da postoje i kao tečnosti, gasovi, a u nekim izuzetnim slučajevima, i u vidu plazme. Sva jedinjenja se mogu razložiti (raspasti) ukoliko se izlože dovoljno visokoj temperaturi. Temperatura pri kojoj se dešava takva fragmentacija često se naziva temperatura raspadanja (termolize). Ta tačka često nije precizno određena i u velikoj meri zavisi od brzine zagrevanja. Na primjer, voda se u maloj meri razlaže na kiseonik i vodonik pri zagrevanju na preko 2000 °C. Neki smatraju da ugljen-dioksid ima najvišu tačku termalnog raspada od preko 3870 °C.
Klase hemijskih jedinjenja
urediHemijska jedinjenja se dele u klase: neorganska i organska.[13] Druga klasa u svojoj široj definiciji uključuje organometalna jedinjenja, kao što su organoboroni, silikoni, organofosforna jedinjenja i drugi.
Neke vrste složenih neorganskih jedinjenja:
- Oksidi (H2O, CaO, CO2 , P2O5 (P4O10) i sl.)
- Hidroksidi
- неорганске киселине (HCl, HCN, i drugi.)
- Nitridi (NH3, Si3N4, itd .)
- Soli (NaCl, KNO3, Fe2 (SO4)3, LiBr, i drugi).
- Hidrat (CuSO4 · 5H2O, i drugi.)
- Kompleksi (K3[Fe(CN)6],[15] i drugi)
Organska jedinjenja
urediOrganska jedinjenja ili organske materije su klasa hemijskih jedinjenja, koja sadrže ugljenik (izuzev karbida, ugljene kiseline, karbonata, oksida ugljenika i cijanid)a.[16]
Neorganska jedinjenja
urediNeorgansko jedinjenje je hemijsko jedinjenje koje nije organsko, tj. ne sadrži ugljenik i (izuzev karbida, cijanida, ugljenikovih oksida i drugih jedinjenja ugljenika koja se tradicionalno nazivaju neorganskim). Neorganskih jedinjenja ne poseduju karakteristični ugljenikov kostur.
Opis glavnih grupa organskih jedinjenja
urediAlifatična jedinjenja
urediAlifatični ugljovodonici se dele u tri grupe homolognih redova na osnovu njihovog stepena zasićenosti:[17]
- parafini ili alkani su ugljovodonici bez dvostruki ili trostrukih veza[18]
- olefini ili alkeni sadrže jednu ili više dvostrukih veza, npr. diolefini (dieni) ili poliolefini
- alkini sadrže jednu ili više trostruke veze.
Ostatak grupe se klasifikuje na osnovu funkcionalnih grupa. Takva jedinjenja mogu da imaju prav lanac, razgranat lanac ili da budu ciklična.
Ciklična jedinjenja mogu da budu zasićena i nezasićena. Najstabilniji prsteni sadrže pet ili šest atoma ugljenika, mada su veliki prsteni (makrociklična jedinjenja) i manji prsteni često sreću. Najmanja cikloalkanska familija je tročlani ciklopropan ((CH2)3). Zasićena ciklična jedinjenja (cikloalkani) sadrže samo jednostruke veze. Cikloalkeni i cikloalkini sadrže dvostruke i trostruke veze.[19]
Aromatična jedinjenja
urediAromatični ugljovodonici sadrže konjugovane dvostruke veze. Najvažniji primer je benzen. Njegovu strukturu je formulisao Kekule koji je prvi predložio princip delokalizacije ili rezonancije radi objašnjavanja strukture. Za „konvencionalna“ ciklična jedinjenja, aromatičnost je određena prisustvom 4n + 2 delokalizovana pi elektrona, gde je n ceo broj. Posebnu nestabilnost (antiaromatičnost) manifestuju jedinjenja sa 4n konjugovana pi elektrona.[20][21][22]
CAS broj
urediZa svaku poznatu supstancu, uključujući i sve hemijske spojeve, dodijeljen je jedinstveni CAS registarski broj, po kojima ih naučnici i istraživači mogu jednoznačno raspoznati.
Reference
uredi- ^ Brown, Theodore L.; Eugene, LeMay H.; Bursten Bruce E. Chemistry: The Central Science, AP Edition (11. izd.). Upper Saddle River, NJ: Prentice Hall. str. 5—6.. 2009. ISBN 978-0-13-236489-8.
- ^ Hill, John W.; Petrucci Ralph H.; McCreary Terry W. General Chemistry (4th izd.). Upper Saddle River, NJ: Prentice Hall. str. 6.. 2005. ISBN 978-0-13-140283-6.
- ^ a b Whitten, Kenneth W.; Davis Raymond E.; Larry, Peck M. (1988). General Chemistry (6. izd.). Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers. str. 15. ISBN 9780030128189.. 2000. ISBN 978-0-03-072373-5.
- ^ Wilbraham, Antony; Michael, Matta; Dennis, Staley; Edward, Waterman (2000). Chemistry (1. izd.). Upper Saddle River, NJ: Prentice Hall. str. 36.. 2002. ISBN 978-0-13-251210-7.
- ^ Halal, John (2008). Milady's Hair Structure and Chemistry Simplified, Chapter 8: General Chemistry (PDF) (5. izd.). Milady Publishing. str. 96—98. ISBN 978-1-4283-3558-5.
- ^ „chemische Verbindung“ im Universal-Lexikon. Arhivirano na sajtu Wayback Machine (9. septembar 2014) Pristupljeno 8. augusta 2012.
- ^ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). „Is hemoglobin an essential structural component of human erythrocyte membranes?”. J Clin Invest. 42 (4): 581—8. PMC 289318 . PMID 13999462. doi:10.1172/JCI104747.
- ^ Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). „Structure of H”. Nature. 185 (4711): 416—422. PMID 18990801. S2CID 4208282. doi:10.1038/185416a0.
- ^ Perutz, M. F. (1960). „Structure of haemoglobin”. Brookhaven Symposia in Biology. 13: 165—83. PMID 13734651.
- ^ Nomenclature of Organic Chemistry; 1958 (A: Hydrocarbons, and B: Fundamental Heterocyclic Systems), 1965 (C: Characteristic Groups) (3rd izd.). London: Butterworths. 1971. ISBN 978-0-408-70144-0.
- ^ Rigaudy, J.; Klesney, S. P., ur. (1979). Nomenclature of Organic Chemistry. IUPAC/Pergamon Press. ISBN 0-08022-3699.. IUPAC, A Guide to IUPAC Nomenclature of Organic Compounds (the Blue Book); Oxford: Blackwell Science (1993). ISBN 0-632-03488-2. Online edition: [1]. . IUPAC, Chemical Nomenclature and Structure Representation Division (27. 10. 2004). Nomenclature of Organic Chemistry (Provisional Recommendations). IUPAC.
- ^ Compendium of Chemical Terminology, IMPACT Recommendations (2nd Ed.), Oxford:Blackwell Scientific Publications. (1997)
- ^ Zumdahl, Steven S. Chemical Principles, Fifth Edition. New York: Houghton Mifflin, 2005. 943–946, 957. OCLC 77760970
- ^ Lidin R.A.; Andreeva, L. L..; Moločko, A. V.. (2006). R. A. Lidina, ur. Konstantы neorganičeskih veщestv: spravočnik. M.: Drofa. str. 685. ISBN 978-5-7107-8085-5.
- ^ Sharpe, A. G. (1976). The Chemistry of Cyano Complexes of the Transition Metals. London: Academic Press.
- ^ Homčenko G. P. Posobie po himii dlя postupaющih v vuzы. — 3-e izd. ispr. i dop. — M.: OOO «Izdatelьstvo Novaя Volna», ZAO «Izdatelьskiй Dom ONIKS», 2000. ISBN 978-5-7864-0103-6. str. 334.. ISBN 978-5-249-00264-0.
- ^ IUPAC (1995). „Aliphatic compounds”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Arora, A. (2006). Hydrocarbons (Alkanes, Alkenes And Alkynes). Discovery Publishing House Pvt. Limited. ISBN 9788183561426.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Schleyer, Paul von Ragué (2001). „Introduction: Aromaticity”. Chemical Reviews. 101 (5): 1115—1118. PMID 11749368. doi:10.1021/cr0103221.
- ^ A. T. Balaban; P. v. R. Schleyer; H. S. Rzepa (2005). „Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons”. Chemical Reviews. 105 (10): 3436—3447. PMID 16218557. S2CID 39440901. doi:10.1021/cr0300946.
- ^ Schleyer, Paul von Ragué (2005). „Introduction: DelocalizationPi and Sigma”. Chemical Reviews. 105 (10): 3433—3435. doi:10.1021/cr030095y.
Literatura
uredi- Arora, A. (2006). Hydrocarbons (Alkanes, Alkenes And Alkynes). Discovery Publishing House Pvt. Limited. ISBN 9788183561426.
- Sharpe, A. G. (1976). The Chemistry of Cyano Complexes of the Transition Metals. London: Academic Press.
- Nomenclature of Organic Chemistry; 1958 (A: Hydrocarbons, and B: Fundamental Heterocyclic Systems), 1965 (C: Characteristic Groups) (3rd izd.). London: Butterworths. 1971. ISBN 978-0-408-70144-0.
- Lidin R.A.; Andreeva, L. L..; Moločko, A. V.. (2006). R. A. Lidina, ur. Konstantы neorganičeskih veщestv: spravočnik. M.: Drofa. str. 685. ISBN 978-5-7107-8085-5.
- Siegfried, Robert. From elements to atoms: a history of chemical composition. American Philosophical Society.. 2002. ISBN 978-0-87169-924-4.
- Pauling, Linus (1970). General Chemistry. New York: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- Ebbin, Darrell D. (1990). General Chemistry, 3rd Ed. Boston: Houghton Mifflin Co. ISBN 978-0-395-43302-7.
- Brown, T. L. (2003). Chemistry – the Central Science, 9th Ed. New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- Chang, Raymond (1998). Chemistry (6th izd.). New York: McGraw Hill. ISBN 978-0-07-115221-1.
- Zumdahl, Steven S. (1997). Chemistry, 4th ed. Boston: Houghton Mifflin. ISBN 978-0-669-41794-4.
- Siegfried, Robert (2002). From elements to atoms: a history of chemical composition. American Philosophical Society. ISBN 978-0-87169-924-4.
- Silberberg, Martin. Chemistry: The Molecular Nature Of Matter and Change. New York: McGraw-Hill Companies. 2004. ISBN 978-0-07-310169-9.
- Pod redakcieй S. M. Lokteva, ur. (1970). Vыsšie žirnыe spirtы (oblasti primeneniя, metodы proizvodstva, fiziko-himičeskie svoйstva). M.: Himiя. str. 329.
- L., Kurc A. G..; Brusova, P.; Demьяnovič, M. V.. (1999). „Odno- i dvuhatomnыe spirtы, prostыe эfirы i ih sernistыe analogi”. Učebnыe materialы. Organičeskaя himiя. ChemNet. Himičeskiй fakulьtet MGU. Arhivirano iz originala 04. 03. 2016. g. Pristupljeno 10. 07. 2010.
- Markizova, F. N..; Grebenюk, N. A..; Bašarin, A. V..; Bonitenko, Ю. E.. (2004). Spirtы. Toksikologiя dlя vračeй. SPb.: «Foliant». str. 112. ISBN 978-5-93929-089-0.
- Reutov, A. O..; Kurc, L. A..; Butin, P. K.. (2010). Organičeskaя himiя. 2. M: Binom. Laboratoriя znaniй. Nepoznati parametar
|DUPLICATE_ref=ignorisan (pomoć) - „Spirtы. Эnciklopediя po ohrane i bezopasnosti truda. Tom IV. Razdel XVIII. Spravočniki. Obzor himičeskih soedineniй”. Institut promыšlennoй bezopasnosti, ohranы truda i socialьnogo partnerstva. Arhivirano iz originala 21. 08. 2011. g. Pristupljeno 12. 02. 2017.
- Himiя. Spravočnoe rukovodstvo. Per. s nem. L., Himiя 1975, ss. 240—242.
- Himičeskaя Эnciklopediя v 5 tomah. red. I. L. Knunяnc. 5 tom.
- Knunяnc, L. I.. (1988). Himičeskaя эnciklopediя. t.1 A-Darzana. M.: Sovetskaя эnciklopediя. str. 623.
- Saйks P. Mehanizmы reakciй v organičeskoй himii. M.: Himiя. 1991
- Adams M. Karbonovыe kislotы v organike. M.: Himiя. 1990
- Dž. Robert, M.Kaserio "Osnovы organičeskoй himii" t. 1 Izdanie 2-e, dopolnennoe. 1978
- Knunяnc, L. I.. (1988). Himičeskaя эnciklopediя. t.1 A-Darzana. M.: Sovetskaя эnciklopediя. str. 623.
- Carl Schorlemmer: Ursprung und Entwicklung der organischen Chemie, Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 1984.
- H. Hart, L.E. Craine, D. J. Hart, C. M. Hadad, N. Kindler: Organische Chemie. 3. izd. Wiley-VCH, Weinheim. 2007. ISBN 978-3-527-31801-8.
- Kurt Peter C. Vollhardt i N.E. Schore: Organische Chemie. 4. izd, Wiley-VCH, Weinheim. 2005. ISBN 978-3-527-31380-8.
- Staab, Heinz A. (1958). „Hundert Jahre organische Strukturchemie”. Angewandte Chemie. 70 (2): 37—41. Bibcode:1958AngCh..70...37S. doi:10.1002/ange.19580700202.
- Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter, Berlin – New York, 3. izd. 2003. ISBN 978-3-11-014683-7.
- Hartmut Laatsch: Die Technik der organischen Trennungsanalyse, Georg Thieme Verlag Stuttgart/New York. 1988. ISBN 978-3-13-722801-1.
- dtv-atlas Chemie (Hans Breuer): Band 2: Organische Chemie und Kunststoffe, 9. izd. . Deutscher Taschenbuch Verlag. 2006. ISBN 978-3-423-03218-6. Nedostaje ili je prazan parametar
|title=(pomoć) - R. L. Shriner, R. C. Fuson, D. Y. Curtin, T. C. Morrill: The Systematic Identification of Organic Compounds – a laboratory manual 6. izd., John Wiley & Sons New York/Chichester/Brisbane/Toronto. 1980. ISBN 978-0-471-78874-4.