Molekularna simetrija
U hemiji, molekularna_simetrija opisuje simetriju prisutnu u molekulima i klasifikaciju ovih molekula prema njihovoj simetriji. Molekularna simetrija je fundamentalni koncept u hemiji, jer se može koristiti za predviđanje ili objašnjenje mnogih hemijskih svojstava molekula, kao što je da li ima ili nema dipolni moment, kao i njegove dozvoljene spektroskopske prelaze. Da bi se to uradilo, potrebno je koristiti teoriju grupa. Ovo uključuje klasifikaciju stanja molekula koristeći nesvodljive reprezentacije iz tabele znakova grupe simetrije molekula. Simetrija je korisna u proučavanju molekularnih orbitala, sa primenama na Hikelov metod, na teoriju polja liganda i na Vudvard-Hofmanova pravila. Mnogi udžbenici na univerzitetskom nivou o fizičkoj hemiji, kvantnoj hemiji, spektroskopiji i neorganskoj hemiji govore o simetriji.[1][2][3][4][5][6] Još jedan okvir na većem obimu je upotreba kristalnih sistema za opisivanje kristalografske simetrije u rasutim materijalima.
Postoji mnogo tehnika za određivanje simetrije datog molekula, uključujući rendgensku kristalografiju i različite oblike spektroskopije. Spektroskopska notacija je zasnovana na razmatranjima simetrije.
Koncepti simetrije grupe tačaka
уреди| Rotaciona osa (Cn) |
Nepravilni rotacioni elementi (Sn) | ||
|---|---|---|---|
| Hiralni ne Sn |
Ahiralna ravan ogledala S1 = σ |
Ahiralni inverzioni centar S2 = i | |
| C1 | |||
| C2 | |||
| Simbol | Operacije simetrije |
|---|---|
| C1 | E |
| Cs | E, σ |
| Ci | E, i |
| Cn | E, Cn |
| Sn | E, Sn (rotaciona reflekcija) |
| Cnv | E, Cn, n*σv |
| Cnh | E, Cn, σh |
| Dn | E, Cn, n*C2(vertikalno) |
| Dnh | E, Cn, n*C2(vertikalno), σh |
| Dnd | E, Cn, n*C2(vertikalno), n*σv(do C2 ose) |
| Td | E, 6*σd, 4*C3, 3*S4 |
| Oh | E, 6*σd, 3*σh, 6*C2, 4*C3, 3*C4, 4*S6 |
Elementi
уредиTačkasta grupna simetrija molekula je definisana prisustvom ili odsustvom 5 tipova elementa simetrije.
- Osa simetrije: osa oko koje rotacija za rezultira molekulom koji se ne razlikuje od originala. Ovo se takođe naziva n-struka rotaciona osa i skraćeno Cn. Primeri su C2 osa u vodi i C3 osa u amonijaku. Molekul može imati više od jedne ose simetrije; ona sa najvećim n naziva se glavna osa, i po konvenciji je poravnata sa z-osom u kartezijanskom koordinatnom sistemu.
- Ravan simetrije: ravan refleksije kroz koju se generiše identična kopija originalnog molekula. Ovo se takođe naziva ravan ogledala i skraćeno σ (sigma = grčko „s“, od nemačkog „Spiegel“ što znači ogledalo)..[7] Voda ima dve: jednu u ravni samog molekula i jednu okomito na njega. Ravan simetrije paralelna sa glavnom osom naziva se vertikalna (σv), a ona normalna na nju horizontalna (σh). Postoji treći tip ravni simetrije: Ako vertikalna ravan simetrije dodatno deli ugao između dve ose rotacije koje su upravne u odnosu na glavnu osu, ravan se naziva diedarska (σd). Ravan simetrije se takođe može identifikovati po njenoj kartezijanskoj orijentaciji, npr. (xz) ili (yz).
- Centar simetrije ili centar inverzije, skraćeno i. Molekul ima centar simetrije kada, za bilo koji atom u molekulu, identičan atom postoji dijametralno nasuprot ovom centru na jednakoj udaljenosti od njega. Drugim rečima, molekul ima centar simetrije kada su tačke (x,y,z) i (−x,−y,−z) identične. Na primer, ako postoji atom kiseonika u nekoj tački (x,y,z), onda postoji atom kiseonika u tački (−x,−y,−z). U samom centru inverzije može biti ili ne mora postojati atom. Primeri su ksenon tetrafluorid gde je centar inverzije na atomu Xe i benzen (C
6H
6) gde je centar inverzije u centru prstena. - Rotaciono-refleksiona osa: osa oko koje je rotacija za , praćena refleksijom u ravni koja je okomita na nju, ostavlja molekul nepromenjenim. Takođe se naziva n-struka nepravilna osa rotacije, skraćeno je Sn. Primeri su prisutni u tetraedarskom silicijum tetrafluoridu, sa tri S4 ose, i stepeničastom konformacijom etana sa jednom S6 osom. Osa S1 odgovara ravni ogledala σ, a osa S2 je centar inverzije i. Molekul koji nema Sn osu za bilo koju vrednost n je hiralni molekul.
- Identitet, skraćeno E, od nemačkog 'Einheit' što znači jedinstvo.[8] Ovaj element simetrije se jednostavno ne sastoji od promene: svaki molekul ima ovaj element simetrije, koji je ekvivalentan C1 pravilnoj rotaciji. On mora biti uključen u listu elemenata simetrije tako da formiraju matematičku grupu, čija definicija zahteva uključivanje elementa identiteta. Tako se zove, jer je analogan množenju sa jedan (jedinicom).[9]
Operacije
уредиPet elemenata simetrije povezuju sa sobom pet tipova simetrijskih operacija, koje ostavljaju da se geometrija molekula ne razlikuje od početne geometrije. Ponekad se razlikuju od elemenata simetrije karetom ili cirkumfleksom. Stoga, Ĉn je rotacija molekula oko ose, a Ê je operacija identiteta. Element simetrije može imati više od jedne operacije simetrije povezane sa njim. Na primer, C4 osa kvadratnog molekula ksenon tetrafluorida (XeF4) povezana je sa dve Ĉ4 rotacije u suprotnim smerovima (90° i 270°), Ĉ2 rotacijom (180°) i Ĉ1 (0° ili 360°). Pošto je Ĉ1 ekvivalentno Ê, Ŝ1 sa σ i Ŝ2 sa î, sve operacije simetrije se mogu klasifikovati kao ispravne ili nepravilne rotacije. Za linearne molekule, rotacija u smeru kazaljke na satu ili u suprotnom smeru oko molekulske ose za bilo koji ugao Φ je operacija simetrije.
Grupe simetrije
уредиGrupe
уредиOperacije simetrije molekula (ili drugog objekta) formiraju grupu. U matematici, grupa je skup sa binarnom operacijom koja zadovoljava četiri svojstva navedena u nastavku.
U grupi simetrije, elementi grupe su operacije simetrije (ne elementi simetrije), a binarna kombinacija se sastoji od primene prvo jedne operacije simetrije, a zatim druge. Primer je sekvenca C4 rotacije oko z-ose i refleksije u xy-ravni, označene kao σ(xy)C4. Po konvenciji redosled operacija je s desna na levo.
Grupa simetrije sledi definišuća svojstva bilo koje grupe.
- Svojstvo zatvorenosti:
Za svaki par elemenata x i y u G, proizvod x*y je takođe u G.(u simbolima, za svaka dva elementa x, y ∈ G, x*y e takođe u G ).To znači da je grupa zatvorena tako da kombinovanje dva elementa ne proizvodi nove elemente. Operacije simetrije imaju ovo svojstvo jer će niz od dve operacije proizvesti treće stanje koje se ne razlikuje od drugog, a samim tim i od prvog, tako da je neto efekat na molekul i dalje operacija simetrije. Ovo se može ilustrovati pomoću tabele. Na primer, sa grupom tačaka C3, postoje tri operacije simetrije: rotacija za 120°, C3, rotacija za 240°, C32 i rotacija za 360°, što je ekvivalentno identičnosti, E.
Tabela C2v množenja grupe tačaka Grupa tačaka C3 Tabela množenja E C3 C32 E E C3 C32 C3 C3 C32 E C32 C32 E C3
- Ova tabela takođe ilustruje sledeća svojstva
- Asocijativno svojstvo:
Za svako x i y i z u G, oba (x*y)*z i x*(y*z) rezultiraju istim elementom u G.( u simbolima, (x*y)*z = x*(y*z ) za svako x, y, i z ∈ G)
- postojanje svojstva identiteta:
Mora postojati element ( recimo e ) u G takav da proizvod bilo kog elementa G sa e ne menja element.( u simbolima, x*e = e*x = x za svako x ∈ G )
- postojanje inverznog elementa:
Za svaki element x u G, mora postojati element y u G takav da je proizvod x i y element identiteta e.( u simbolima, za svako x ∈ G postoji y ∈ G takvo da je x*y = y*x = e za svako x ∈ G )
Redosled grupe je broj elemenata u grupi. Za grupe malih redova, svojstva grupe mogu se lako proveriti razmatranjem njene kompozicione tabele, tabele čiji redovi i kolone odgovaraju elementima grupe i čiji unosi odgovaraju njihovim produktima.
Grupe tačaka i grupe permutacije-inverzije
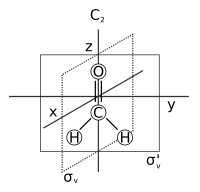
уредиUzastopna primena (ili kompozicija) jedne ili više operacija simetrije molekula ima efekat ekvivalentan onom kod neke pojedinačne operacije simetrije molekula. Na primer, C2 rotacija praćena σv refleksijom se vidi kao σv' operacija simetrije: σv*C2 = σv'. („Operacija A praćena sa B u formu C“ piše se BA = C).[9] Štaviše, skup svih operacija simetrije (uključujući ovu operaciju kompozicije) poštuje sva svojstva grupe, date gore. Dakle (S,*) je grupa, gde je S skup svih operacija simetrije nekog molekula, a * označava kompoziciju (ponovnu primenu) operacija simetrije.
Ova grupa se naziva grupa tačaka tog molekula, jer skup operacija simetrije ostavlja najmanje jednu tačku fiksnu (iako za neke simetrije cela osa ili cela ravan ostaje fiksna). Drugim rečima, grupa tačke je grupa koja sumira sve operacije simetrije koje imaju svi molekuli u toj kategoriji.[9] Nasuprot tome, simetrija kristala je opisana prostornom grupom operacija simetrije, koja uključuje translacije u prostoru.
Operacije simetrije grupe tačaka se mogu odrediti za određeni molekul uzimajući u obzir geometrijsku simetriju njegovog molekularnog modela. Međutim, kada se koristi tačkasta grupa za klasifikaciju molekularnih stanja, operacije u njoj se ne tumače na isti način. Umesto toga, operacije se tumače kao rotirajuće i/ili da odražavaju vibronske (vibraciono-elektronske) koordinate[10] i ove operacije komutuju sa vibracionim Hamiltonijanom. To su „operacije simetrije”" za taj vibracioni Hamiltonijan. Tačkasta grupa se koristi za klasifikaciju vibracionih sopstvenih stanja krutog molekula po simetriji. Klasifikacija simetrije rotacionih nivoa, sopstvenih stanja punog (rotaciono-vibraciono-elektronskog) Hamiltonijana, zahteva upotrebu odgovarajuće permutaciono-inverzione grupe koju je uveo Longvet-Higins.[11] Grupe tačaka opisuju geometrijsku simetriju molekula, dok grupe permutacije-inverzije opisuju energetsko invarijantnu simetriju.
Primeri grupa tačaka
уредиDodeljivanje grupe tačaka svakom molekulu klasifikuje molekule u kategorije sa sličnim svojstvima simetrije. Na primer, PCl3, POF3, XeO3, i NH3 svi dele identične operacije simetrije.[12] Svi oni mogu da se podvrgnu operaciji identiteta E, dve različite C3 operacije rotacije i tri različite σv refleksije u ravni bez promene njihovog identiteta, tako da su smešteni u jednu grupu tačaka, C3v, sa redosledom 6.[9] Slično, voda (H2O) i vodonik sulfid (H2S) takođe dele identične operacije simetrije. Oba molekula prolaze kroz operaciju identiteta E, jednu C2 rotaciju i dve σv refleksije bez promene identiteta, tako da su oba smeštena u jednu tačkastu grupu, C2v, sa redosledom 4.[13] Ovaj sistem klasifikacije pomaže naučnicima da efikasnije proučavaju molekule, pošto hemijski srodni molekuli u istoj grupi tačaka imaju tendenciju da pokazuju slične sheme vezivanja, dijagrame molekularnog vezivanja i spektroskopska svojstva.[9] Simetrija grupe tačaka opisuje simetriju molekula kada je fiksiran u svojoj ravnotežnoj konfiguraciji u određenom elektronskom stanju. Ona ne dozvoljava tuneliranje između minimuma niti promenu oblika do kojih može doći usled efekata centrifugalnog izobličenja molekularne rotacije.
Zajedničke grupe tačaka
уредиSledeća tabela navodi mnoge grupe tačaka koje se primenjuju na molekule, označene pomoću Šoenflajesove notacije, koja je uobičajena u hemiji i molekularnoj spektroskopiji. Opisi uključuju uobičajene oblike molekula, koji se mogu objasniti VSEPR modelom. U svakom redu, opisi i primeri nemaju veće simetrije, što znači da imenovana grupa tačaka obuhvata sve simetrije tačaka.
| Grupa tačaka | Operacije simetrije[14] | Jednostavan opis tipične geometrije | Primer 1 | Primer 2 | Primer 3 |
|---|---|---|---|---|---|
| C1 | E | nema simetrije, hiralan | bromohlorofluorometan (oba enantiomera su prikazana) |
lizerginska kiselina |
L-leucin i većina drugih α-aminokiselina izuzev glicina |
| Cs | E σh | ravan ogledala | tionil hlorid |
Hipohlorasta kiselina |
hlorojodometan |
| Ci | E i | inverzioni centar | meso-vinska kiselina |
mucična kiselina (meso-galaktarinska kiselina) |
|
| C∞v | E 2C∞Φ ∞σv | linearna | fluorovodonik (a svi ostali heteronuklearni diatomski molekuli) |
azot-suboksid (diazot monoksid) |
cijanovodonična kiselina (vodonik cijanid) |
| D∞h | E 2C∞Φ ∞σi i 2S∞Φ ∞C2 | linearna sa inverzionim centrom | oxygen (i svi drugi homonuklearni dvoatomski molekuli) |
ugljen dioksid |
acetilen (etin) |
| C2 | E C2 | „geometrija otvorene knjige”, hiralna | vodonik peroksid |
hidrazin |
tetrahidrofuran (konformacija uvijanja) |
| C3 | E C3 C32 | propeler, hiralna | trifenilfosfin |
trietilamin |
fosforna kiselina |
| C2h | E C2 i σh | ravan sa centrom inverzije, bez vertikalne ravni | trans-1,2-dihloroetilen |
trans-diazot difluorid |
trans-azobenzen |
| C2v | E C2 σv(xz) σv'(yz) | uglasta (H2O) ili testerasta (SF4) | voda |
sumpor tetrafluorid |
dihlorometan |
| C3h | E C3 C32 σh S3 S35 | propeler | borna kiselina |
floroglucinol (1,3,5-trihidroksibenzen) |
|
| C3v | E 2C3 3σv | trigonalno piramidalna | amonijak (ako se zanemari pirimidalna inverzija) |
fosforil hlorid |
kobalt tetrakarbonil hidrid, HCo(CO)4 |
| C4v | E 2C4 C2 2σv 2σd | kvadratno piramidalna | ksenon oksitetrafluorid |
pentaboran(9), B5H9 |
nitroprusidni anjon [Fe(CN)5(NO)]2− |
| C5 | E 2C5 2C52 | peterostruka rotacijska simetrija | C-reaktivni protein |
||
| C5v | E 2C5 2C52 5σv | kompleks 'stolice za mužu' | ciklopentadienil nikal nitrozil (CpNiNO) |
koranulen |
|
| D2 | E C2(x) C2(y) C2(z) | zaokret, hiralna | bifenil (iskrivljena konformacija) |
tvistan (C10H16) |
|
| D3 | E C3(z) 3C2 | trostruki heliks, hiralna | Tris(etilendiamin)kobalt(III) katjon |
tris(oksalat)gvožđe(III) anjon |
|
| D2h | E C2(z) C2(y) C2(x) i σ(xy) σ(xz) σ(yz) | planarna sa centrom inverzije, vertikalna ravan | etilen |
pirazin |
diboran |
| D3h | E 2C3 3C2 σh 2S3 3σv | trigonalno planarna ili trigonalno bipiramidalna | bor trifluorid |
fosfor pentahlorid |
ciklopropan |
| D4h | E 2C4 C2 2C2' 2C2" i 2S4 σh 2σv 2σd | kvadratno planarna | ksenon tetrafluorid |
oktahlorodimolibdat(II) anjon |
Trans-[CoIII(NH3)4Cl2]+ (isključujući H atome) |
| D5h | E 2C5 2C52 5C2 σh 2S5 2S53 5σv | pentagonalna | ciklopentadienilni anjon |
rutenocen |
C70 |
| D6h | E 2C6 2C3 C2 3C2' 3C2‘’ i 2S3 2S6 σh 3σd 3σv | heksagonalna | benzen |
bis(benzen)hrom |
koronen (C24H12) |
| D7h | E C7 S7 7C2 σh 7σv | heptagonalna | tropilijum (C7H7+) katjon |
||
| D8h | E C8 C4 C2 S8 i 8C2 σh 4σv 4σd | oktagonalna | ciklooktatetraenid (C8H82−) anion |
uranocen |
|
| D2d | E 2S4 C2 2C2' 2σd | 90° zaokret | alen |
tetrasumpor tetranitrid |
diboran(4) (pobuđeno stanje) |
| D3d | E 2C3 3C2 i 2S6 3σd | 60° zaokret | etan (anti rotamer) |
dikobalt oktakarbonil (nepremošteni izomer) |
cikloheksanska konformacija stolice |
| D4d | E 2S8 2C4 2S83 C2 4C2' 4σd | 45° zaokret | sumpor (konformacija krune S8) |
dimangan dekakarbonil (anti rotamer) |
oktafluoroksenatni jon (idealizovana geometrija) |
| D5d | E 2C5 2C52 5C2 i 2S103 2S10 5σd | 36° zaokret | ferocen (anti rotamer) |
||
| S4 | E 2S4 C2 | 1,2,3,4-tetrafluorospiropentan (mezo izomer)[15] |
|||
| Td | E 8C3 3C2 6S4 6σd | tetraedralna | metan |
fosfor pentoksid |
adamantan |
| Th | E 4C3 4C32 i 3C2 4S6 4S65 3σh | piritoedarska | |||
| Oh | E 8C3 6C2 6C4 3C2 i 6S4 8S6 3σh 6σd | oktaedarska ili kubna | sumpor heksafluorid |
molibden heksakarbonil |
kuban |
| I | E 12C5 12C52 20C3 15C2 | hiralna ikosaedarska ili dodekaedrska | rinovirus |
||
| Ih | E 12C5 12C52 20C3 15C2 i 12S10 12S103 20S6 15σ | ikosaedarska ili dodekaedarska | bukminsterfuleren |
dodekaboratni anjon |
dodekaedran |
Reprezentacije
уредиSkup matrica koje se množe zajedno na način koji oponaša tabelu množenja elemenata grupe naziva se reprezentacija grupe. Na primer, za C2v grupu tačaka, sledeće tri matrice su deo reprezentacije grupe:
Iako postoji beskonačan broj takvih reprezentacija, nesvodljive reprezentacije (ili „irreps”) grupe su sve što je potrebno, jer se sve druge reprezentacije grupa mogu opisati kao linearna kombinacija nesvodljivih reprezentacija. Takođe, nesvodljive reprezentacije su one matrične reprezentacije u kojima su matrice u svom najdijagonalnijem mogućem obliku.
Tabele znakova
уредиZa bilo koju grupu, njena tabela oznaka daje tabelarni prikaz (za klase grupe) znakova (zbir dijagonalnih elemenata) matrice svih nesvodljivih reprezentacija grupe. Kako je broj nesvodljivih reprezentacija jednak broju klasa, tabela znakova je kvadratna.
Reprezentacije su označene u skladu sa setom konvencija:
- A, kada je rotacija oko glavne ose simetrična
- B, kada je rotacija oko glavne ose asimetrična
- E i T su dvostruko i trostruko degenerisane reprezentacije, respektivno
- kada grupa tačaka ima centar inverzije, indeks g (нем. gerade ili ujednačen) signalizira da nema promene u predznaku, a indeks u (ungerade ili neujednačen) promenu predznaka, u odnosu na inverziju.
- kod grupa tačaka C∞v i D∞h simboli su pozajmljeni iz opisa ugaonog momenta: Σ, Π, Δ.
Tabele takođe obuhvataju informacije o tome kako se kartezijanski bazni vektori, rotacije oko njih i njihove kvadratne funkcije transformišu operacijama simetrije grupe, primećujući koja se nesvodljiva reprezentacija transformiše na isti način. Ove indikacije su konvencionalno na desnoj strani tabele. Ova informacija je korisna, jer hemijski važne orbitale (posebno p i d orbitale) imaju iste simetrije kao ovi entiteti.
Tabela karaktera za grupu tačaka simetrije C2v je data u nastavku:
| C2v | E | C2 | σv(xz) | σv'(yz) | ||
|---|---|---|---|---|---|---|
| A1 | 1 | 1 | 1 | 1 | z | x2, y2, z2 |
| A2 | 1 | 1 | −1 | −1 | Rz | xy |
| B1 | 1 | −1 | 1 | −1 | x, Ry | xz |
| B2 | 1 | −1 | −1 | 1 | y, Rx | yz |
Razmotrite primer vode (H2O), koja ima C2v simetriju opisanu iznad. Orbitala kiseonika od 2px ima B1 simetriju kao u četvrtom redu tabele znakova iznad, sa x u šestoj koloni). Ona je orijentisana normalno na ravan molekula i menja znak sa C2 i σv'(yz) operacijom, ali ostaje nepromenjena sa druge dve operacije (očigledno, karakter za operaciju identiteta je uvek +1). Skup znakova ove orbitale je stoga {1, −1, 1, −1}, što odgovara B1 nesvodljivoj reprezentaciji. Isto tako, vidi se da 2pz orbitala ima simetriju A1</sub nesvodljive reprezentacije (tj.: nijedna od operacija simetrije je ne menja), 2py B2 i 3dxy orbitala A2. Ove i druge naznake su zabeleženi u dve krajnje desne kolone tabele.
Istorijska pozadina
уредиHans Bete je koristio oznake operacija tačkastih grupa u svojoj studiji teorije polja liganda 1929. godine, a Judžin Vigner je koristio teoriju grupa da objasni pravila selekcije atomske spektroskopije.[16] Prve tabele karaktera sastavio je Laslo Tisa (1933), u vezi sa vibracionim spektrima. Robert Maliken je prvi objavio tabele karaktera na engleskom (1933), a E. Brajt Vilson ih je koristio 1934. da predvidi simetriju vibracionih normalnih modova.[17] Kompletan set od 32 grupe kristalografskih tačaka objavili su 1936. Rozental i Marfi.[18]
Molekularna rotacija i molekularna nekrutost
уредиKao što je gore objašnjeno u odeljku Grupe tačaka i grupe permutacije-inverzije, grupe tačaka su korisne za klasifikaciju vibracionih i elektronskih stanja krutih molekula (ponekad se nazivaju polukruti molekuli) koji prolaze samo kroz male oscilacije oko jedne ravnotežne geometrije. Longvet-Higins je uveo opštiji tip grupe simetrije[11] pogodan ne samo za klasifikaciju vibracionih i elektronskih stanja krutih molekula već i za klasifikaciju njihovih rotacionih i nuklearnih spinskih stanja. Dalje, takve grupe se mogu koristiti za klasifikaciju stanja nekrutih (ili fluksionih) molekula koji tuneliraju između ekvivalentnih geometrija (koje se nazivaju verzije[19]) i da bi se omogućili efekti izobličenja molekularne rotacije. Ove grupe su poznate kao permutaciono-inverzione grupe, jer su operacije simetrije u njima energetski izvodljive permutacije identičnih jezgara, ili inverzija u odnosu na centar mase (operacija parnosti), ili kombinacija ova dva.
Na primer, etan (C2H6) ima tri ekvivalentne stepeničaste konformacije. Tuneliranje između konformacija se dešava na uobičajenim temperaturama unutrašnjom rotacijom jedne metil grupe u odnosu na drugu. Ovo nije rotacija celog molekula oko ose C3. Iako svaka konformacija ima D3d simetriju, kao u gornjoj tabeli, opis unutrašnje rotacije i povezanih kvantnih stanja i nivoa energije zahteva potpuniju permutaciono-inverzionu grupu G36.[20]
Slično, amonijak (NH3) ima dve ekvivalentne piramidalne (C3v) konformacije koje se međusobno konvertuju procesom poznatim kao azotna inverzija. Ovo nije operacija inverzije grupe tačaka i koja se koristi za centrosimetrične krute molekule (tj. inverzija vibracionih pomeranja i elektronskih koordinata u nuklearnom centru mase) pošto NH3 nema centar inverzije i nije centrosimetričan. Umesto toga, to je inverzija nuklearnih i elektronskih koordinata u molekularnom centru mase (ponekad se naziva operacija parnosti), što je energetski izvodljivo za ovaj molekul. Odgovarajuća permutaciono-inverziona grupa koja se koristi u ovoj situaciji je D3h(M)[21] koja je izomorfna sa grupom tačaka D3h.
Pored toga, kao primeri, molekuli metana (CH4) i H3+ imaju visoko simetrične ravnotežne strukture sa simetrijama Td i D3h tačka, respektivno; nedostaju im trajni električni dipolni momenti, ali imaju veoma slab spektar čiste rotacije zbog rotacionog centrifugalnog izobličenja.[22][23] Permutaciono-inverzione grupe potrebne za kompletno proučavanje CH4 i H3+ Td(M)[24] i D3h(M), respektivno.
U svom osnovnom (N) elektronskom stanju, molekul etilena C2H4 ima simetriju D2h tačkaste grupe, dok u pobuđenom (V) stanju ima D2d simetriju. Za tretiranje ova dva stanja zajedno potrebno je dozvoliti torziju i koristiti dvostruku grupu permutaciono-inverzione grupe G16.[25]
Drugi i manje opšt pristup simetriji nečvrstih molekula je Altmanov doprinos.[26][27] U ovom pristupu grupe simetrije su poznate kao Šredingerove supergrupe i sastoje se od dva tipa operacija (i njihovih kombinacija): (1) operacije geometrijske simetrije (rotacije, refleksije, inverzije) krutih molekula i (2) izodinamičke operacije, koje prevode nečvrsti molekul u energetski ekvivalentan oblik fizički razumnim procesom kao što je rotacija oko jedne veze (kao u etanu) ili molekularna inverzija (kao u amonijaku).[27]
Vidi još
уреди- Paritet (fizika) § Molekuli
- Ireducibilna reprezentacija § Primene u teorijskoj fizici i hemiji
- Vudvard-Hofmanova pravila § Korelacioni dijagrami
- Haptičnost § Haptičnost i promenljivost
- Tabela znakova
- Grupa kristalografskih tačaka
- Grupe tačaka u tri dimenzije
- Simetrija dvoatomskih molekula
- Simetrija u kvantnoj mehanici
Reference
уреди- ^ Quantum Chemistry, 3rd ed. John P. Lowe, Kirk Peterson. ISBN 0-12-457551-X.
- ^ Physical Chemistry (1997). A Molecular Approach by Donald A. McQuarrie, John D. Simon. ISBN 0-935702-99-7.
- ^ The chemical bond, 2nd ed. J.N. Murrell, S.F.A. Kettle, J.M. Tedder. ISBN 0-471-90760-X.
- ^ Physical Chemistry, 8th ed. P.W. Atkins and J. de Paula, W.H. Freeman, 2006 ISBN 0-7167-8759-8, chap.12
- ^ G. L. Miessler and D. A. Tarr Inorganic Chemistry, 2nd ed. Pearson, Prentice Hall, 1998 ISBN 0-13-841891-8, chap.4.
- ^ Bunker, Philip; Jensen, Per (2006). Molecular Symmetry and Spectroscopy, Second edition. Ottawa: NRC Research Press. ISBN 0-660-19628-X.
- ^ „Symmetry Operations and Character Tables”. University of Exeter. 2001. Приступљено 29. 5. 2018.
- ^ LEO Ergebnisse für "einheit"
- ^ а б в г д Pfenning, Brian (2015). Principles of Inorganic Chemistry. John Wiley & Sons. ISBN 9781118859025.
- ^ P. R. Bunker and P. Jensen (2005),Fundamentals of Molecular Symmetry (CRC Press)ISBN 0-7503-0941-5 [1] Section 8.3
- ^ а б Longuet-Higgins, H.C. (1963). „The symmetry groups of non-rigid molecules”. Molecular Physics. 6 (5): 445—460. Bibcode:1963MolPh...6..445L. doi:10.1080/00268976300100501 .
- ^ Pfennig, Brian (30. 3. 2015). Principles of Inorganic Chemistry. Wiley. стр. 191. ISBN 978-1-118-85910-0.
- ^ Miessler, Gary (2004). Inorganic Chemistry . Pearson. ISBN 9780321811059.
- ^ Miessler, Gary L. (1999). Inorganic Chemistry (2nd изд.). Prentice-Hall. стр. 621–630. ISBN 0-13-841891-8. „Character tables (all except D7h)”
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. стр. 111—112. ISBN 978-0-13-175553-6.
- ^ Group Theory and its application to the quantum mechanics of atomic spectra, E. P. Wigner, Academic Press Inc. (1959)
- ^ Correcting Two Long-Standing Errors in Point Group Symmetry Character Tables Randall B. Shirts J. Chem. Educ. 2007, 84, 1882. Abstract Архивирано на сајту Wayback Machine (31. август 2009)
- ^ Rosenthal, Jenny E.; Murphy, G. M. (1936). „Group Theory and the Vibrations of Polyatomic Molecules”. Rev. Mod. Phys. 8 (4): 317—346. Bibcode:1936RvMP....8..317R. doi:10.1103/RevModPhys.8.317.
- ^ Bone, R.G.A.; et al. (1991). „Transition states from molecular symmetry groups:Analysis of non-rigid acetylene trimer”. Molecular Physics. 72 (1): 33—73. Bibcode:1991MolPh..72...33B. doi:10.1080/00268979100100021.
- ^ P. R. Bunker (1964). „The Rotation-Torsion Wavefunctions of Molecules that have two Identical Rotors”. Mol. Phys. 8: 81. doi:10.1080/00268976400100091.
- ^ P.R. Bunker 'Practically Everything you Ought to know about the Molecular Symmetry Group' in, ‘Vibrational Spectra and Structure, Vol. III’, ed. James R. Durig, Marcel Dekker. 1975. ISBN 0824711491.
- ^ Watson, J.K.G (1971). „Forbidden rotational spectra of polyatomic molecules”. Journal of Molecular Spectroscopy. 40 (3): 546—544. Bibcode:1971JMoSp..40..536W. doi:10.1016/0022-2852(71)90255-4.
- ^ Oldani, M.; et al. (1985). „Pure rotational spectra of methane and methane-d4 in the vibrational ground state observed by microwave Fourier transform spectroscopy”. Journal of Molecular Spectroscopy. 110 (1): 93—105. Bibcode:1985JMoSp.110...93O. doi:10.1016/0022-2852(85)90215-2.
- ^ P. R. Bunker; Jensen, Per (1999). „Spherical top molecules and the molecular symmetry group”. Mol. Phys. 97 (1–2): 255. Bibcode:1999MolPh..97..255B. doi:10.1080/00268979909482827.
- ^ Watson, J.K.G.; et al. (1996). „Theory of odd torsional transitions in the V−N resonance Raman spectrum of ethylene”. J Chem Phys. 105 (4): 1348. Bibcode:1996JChPh.105.1348W. doi:10.1063/1.472001 .
- ^ Altmann S.L. (1977) Induced Representations in Crystals and Molecules, Academic Press
- ^ а б Flurry, R.L. (1980) Symmetry Groups, Prentice-Hall, ISBN 0-13-880013-8, pp. 115-127
Literatura
уреди- Barnes, K.J. (2010). Group theory for the standard model and beyond. Series in high energy physics, cosmology, and gravitation. Taylor & Francis. ISBN 978-142-007-874-9.
- Chaichian, M.; Hagedorn, R. (1998). Symmetry in quantum mechanics: From angular momentum to supersymmetry. Graduate student series in physics. Institute of physics (Bristol and Philadelphia). ISBN 0-7503-0408-1.
- Hall, Brian C. (2013). Quantum Theory for Mathematicians. Graduate Texts in Mathematics. 267. Springer. Bibcode:2013qtm..book.....H. ISBN 978-1-4614-7115-8. S2CID 117837329. doi:10.1007/978-1-4614-7116-5.
- Hall, Brian C. (2015). Lie Groups, Lie Algebras, and Representations: An Elementary Introduction. Graduate Texts in Mathematics. 222 (2nd изд.). Springer. ISBN 978-3-319-13466-6. doi:10.1007/978-3-319-13467-3.
- Haywood, S. (2011). Symmetries and Conservation Laws in Particle Physics: An Introduction to Group Theory for Particle Physicists. World Scientific. ISBN 978-184-816-703-2.
- Ladd, M.F.C. (1989). Symmetry in molecules and crystals. Solid state science. Ellis Horwood series in physical chemistry. ISBN 0-85312-255-5.
- Ludwig, W.; Falter, C. (1996). Symmetries in physics. Solid state science (2nd изд.). Springer. ISBN 3-540-60284-4.
- Martin, B.R.; Shaw, G. (2013). Particle Physics. Manchester Physics Series (3rd изд.). Wiley. ISBN 978-0-470-03294-7.
- McMahon, D. (2008). Quantum Field Theory. McGraw Hill. ISBN 978-0-07-154382-8.
- Moretti, V. (2017). Spectral Theory and Quantum Mechanics; Mathematical Foundations of Quantum Theories, Symmetries and Introduction to the Algebraic Formulation. Unitext. 110 (2nd изд.). Springer. Bibcode:2017stqm.book.....M. ISBN 978-3-319-70705-1. S2CID 125121522. doi:10.1007/978-3-319-70706-8.
- Reece, R.D. (2006). „A Derivation of the Quantum Mechanical Momentum Operator in the Position Representation”.
- Soper, D.E. (2011). „Position and momentum in quantum mechanics” (PDF).
- Porter, F. (2009). „Lie Groups and Lie Algebras” (PDF). Архивирано из оригинала (PDF) 2017-03-29. г. Приступљено 2013-06-05.
- Mulders, P.J. (новембар 2011). „Quantum field theory” (PDF). Department of Theoretical Physics, VU University. 6.04.
- Hall, B.C. (2000). „An Elementary Introduction to Groups and Representations”. arXiv:math-ph/0005032 .
- Quantum Mechanics, Third Edition: Non-Relativistic Theory (Volume 3)by L. D. Landau, L. M. Lifshitz; ISBN 978-0750635394 Edition: 3rd; chapters: XI and XII.
- Physics of Atoms & Molecules by B.H. Bransden, C.J. Joachain; ISBN 978-8177582796 Edition: 2nd edition; chapter: 9
- Molecular Spectra and Molecular Structure: Spectra of Diatomic Molecules by Gerhard Herzberg; ISBN 978-0894642685 Edition: 2nd
- Molecular Quantum Mechanics by Peter W. Atkins, Ronald S. Friedman; ISBN 978-0199541423 Edition: 5th; chapter: 10.
- Lecture notes on Quantum Mechanics (handouts: 12, 10) by Prof. Sourendu Gupta, Tata Institute of Fundamental Research, Mumbai.
- Symmetry in Physics: Principles and Simple Applications Volume 1 by James Philip Elliott, P.G. Dawber; ISBN 978-0195204551
- A Modern Approach to Quantum Mechanics by John S. Townsend; Edition 2nd; ISBN 978-1891389788
- Perkins, Donald H. (2000). Introduction to High Energy Physics. ISBN 9780521621960.
- Sozzi, M. S. (2008). Discrete symmetries and CP violation. Oxford University Press. ISBN 978-0-19-929666-8.
- Bigi, I. I.; Sanda, A. I. (2000). CP Violation. Cambridge Monographs on Particle Physics, Nuclear Physics and Cosmology. Cambridge University Press. ISBN 0-521-44349-0.
- Weinberg, S. (1995). The Quantum Theory of Fields. Cambridge University Press. ISBN 0-521-67053-5.
- Coxeter, H. S. M. (1974), „7 The Binary Polyhedral Groups”, Regular Complex Polytopes, Cambridge University Press, стр. 73–82.
- Coxeter, H. S. M.; Moser, W. O. J. (1980). Generators and Relations for Discrete Groups, 4th edition. New York: Springer-Verlag. ISBN 0-387-09212-9. 6.5 The binary polyhedral groups, p. 68
- Conway, John Horton; Huson, Daniel H. (2002), „The Orbifold Notation for Two-Dimensional Groups”, Structural Chemistry, Springer Netherlands, 13 (3): 247—257, S2CID 33947139, doi:10.1023/A:1015851621002
Spoljašnje veze
уреди- Grupna simetrija tačaka na Univerzitetu Njukasl
- Molekularna simetrija na Imperijalnom koledžu London
- Tabele simetrije grupe molekulskih tačaka
- [https://web.archive.org/web/20230328010349/https://gernot-katzers-spice-pages.com/character_tables/index.html Архивирано на сајту Wayback Machine (28. март 2023) Tabele znakova za grupe tačaka za hemiju]
- Molekularna simetrija onlajn na Otvorenom univerzitetu Izraela
- Internet kurs predavanja o molekularnoj simetriji na Bergiše univerzitetu
- DECOR – Simmetrija @ Kembridž kristalografski centar podataka
- Detalji odnosa između grupa tačaka i grupa permutacije-inverzije, Filip Bunker