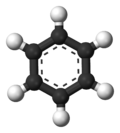
Benzen
Benzen (trivijalni naziv: benzol), molekulske formule C6H6, najjednostavniji je aromatični ugljovodonik. Otkrio ga je Majkl Faradej 1825. godine. Osnovno jedinjenje velike grupe organskih aromatičnih jedinjenja - arena. To je bezbojna tečnost karakterističnog mirisa i male viskoznosti, gustina 0,885 g/cm³, tačka topljenja 5,5 °C, tačka ključanja 80,2 °C. Gori svetlim i jako čađavim plamenom. Otrovan je i kancerogen i u tečnom i u gasovitom stanju. Dobija se pri suvoj destilaciji uglja u koksarama, na području nekadašnje Jugoslavije u Lukavcu i Zenici. Znatne količine se proizvode i sintetički, katalitičkim krekovanjem alifatičnih i naftenskih ugljovodonika. U svetu je 1975. godine proizvedeno 8,92 miliona tona. Upotrebljava se u hemijskoj industriji kao rastvarač, sredstvo za ekstrakciju i kao sirovina za druge proizvode.
| |||
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Benzen
| |||
| Preferisani IUPAC naziv
Benzene[1] | |||
| Sistemski IUPAC naziv
cikloheksa-1,3,5-trien | |||
Drugi nazivi
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.685 | ||
| EC broj | 200-753-7 | ||
| KEGG[2] | |||
| RTECS | CY1400000 | ||
| UNII | |||
| |||
| |||
| Svojstva | |||
| C6H6 | |||
| Molarna masa | 78,11 g·mol−1 | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Miris | aromatičan, sličan benzinu | ||
| Gustina | 0,8765(20) g/cm³[5] | ||
| Tačka topljenja | 5,53 °C (41,95 °F; 278,68 K) | ||
| Tačka ključanja | 80,1 °C (176,2 °F; 353,2 K) | ||
| 1.53 g/L (0 °C) 1.81 g/L (9 °C) 1.79 g/L (15 °C)[6][7][8] 1.84 g/L (30 °C) 2.26 g/L (61 °C) 3.94 g/L (100 °C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[9] | |||
| Rastvorljivost | rastvoran u alkoholu, hloroformu, CCl4, dietil etru, acetonu, sirćetnoj kiselini[9] | ||
| Rastvorljivost u etandiol | 5,83 g/100 g (20 °C) 6,61 g/100 g (40 °C) 7,61 g/100 g (60 °C)[9] | ||
| Rastvorljivost u etanol | 20 °C, rastvor u vodi: 1,2 mL/L (20% v/v)[10] | ||
| Rastvorljivost u aceton | 20 °C, rastvor u vodi: 7,69 mL/L (38,46% v/v) 49,4 mL/L (62,5% v/v)[10] | ||
| Rastvorljivost u dietilen glikol | 52 g/100 g (20 °C)[9] | ||
| log P | 2,13 | ||
| Napon pare | 12,7 kPa (25 °C) 24,4 kPa (40 °C) 181 kPa (100 °C)[11] | ||
| Konjugovana kiselina | benzenijum | ||
| λmax | 255 nm | ||
| Magnetna susceptibilnost | −54,8·10−6 cm³/mol | ||
| Indeks refrakcije (nD) | 1,5011 (20 °C) 1,4948 (30 °C)[9] | ||
| Viskoznost | 0,7528 cP (10°,) 0,6076 cP (25 °C) 0,4965 cP (40 °C) 0,3075 cP (80 °C) | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | Trigonalno planarna | ||
| Dipolni moment | 0 D | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 134,8 J/mol·K | ||
Standardna molarna
entropija (S |
173,26 J/mol·K[11] | ||
Standardna entalpija
stvaranja (ΔfH |
48,7 kJ/mol | ||
Std entalpija
sagorevanja (ΔcH⦵298) |
3267,6 kJ/mol[11] | ||
| Опасности | |||
| Главне опасности | потенцијални радни карциноген, запаљив | ||
| Безбедност приликом руковања | HMDB | ||
| GHS piktogrami |      [12] [12]
| ||
| GHS signalne reči | Opasnost | ||
| H225, H304, H315, H319, H340, H350, H372, H410[12] | |||
| P201, P210, P301+310, P305+351+338, P308+313, P331[12] | |||
| NFPA 704 | |||
| Tačka paljenja | −11,63 °C (11,07 °F; 261,52 K) | ||
| 497,78 °C (928,00 °F; 770,93 K) | |||
| Eksplozivni limiti | 1,2–7,8% | ||
| Smrtonosna doza ili koncentracija (LD, LC): | |||
LD50 (srednja doza)
|
930 mg/kg (pacov, oralno) | ||
LCLo (najniža objavljena)
|
44.000 ppm (zec, 30 min) 44.923 ppm (pas) 52.308 ppm (mačka) 20.000 ppm (čovek, 5 min)[14] | ||
| Granice izloženosti zdravlja u SAD (NIOSH): | |||
PEL (dozvoljeno)
|
TWA 1 ppm, ST 5 ppm[13] | ||
REL (preporučeno)
|
Ca TWA 0.1 ppm ST 1 ppm[13] | ||
IDLH (trenutna opasnost)
|
500 ppm[13] | ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
|||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Benzenov prsten
urediBenzenov prsten je šestočlani prsten koji obrazuju atomi ugljenika u strukturi molekula ugljovodonika benzola. Osnovni je strukturni sastojak organskih aromatičnih jedinjenja. Slobodni elektronski parovi ugljenika u prstenu su delokalizovani i iznad i ispod ravni prstena grade delokalizovane elektronske oblake. Ovakva struktura je hemijski veoma postojana pa su jedinjenja koja poseduju benzenov prsten, i pored postojanja nezasićenih veza, pretežno dezaktivirana za reakciju adicije. Prsten je pak podložan elektrofilnom napadu odnosno elektrofilnoj aromatičnoj supstituciji pri kojoj se očuvava aromatičnost (posebna pažnja se obraća na redosled uvođenja supstituenata zbog njihovih direkcionih uticaja). Dobijeni derivati imaju široku primenu.
Istorija
urediOtkriće
urediReč „benzen” je izvedena iz „gumenog benzoina” (benzoinske smole), aromatične smole koju su evropski farmaceuti i parfemeri poznaju od 16. veka kao proizvod iz jugoistočne Azije.[15] Jedan kiseli materijal je izveden iz benzoina sublimacijom i nazvan „cvetovi benzoina”, ili benzojeva kiselina. Ugljovodonici koji su dobijeni iz benzojeve kiseline tako su dobili ime benzin, benzol ili benzen.[16] Majkl Faradej je prvi izolovao i identifikovao benzen 1825. godine iz uljanog ostatka dobijenog iz proizvodnje iluminirajućeg gasa, i dao mu ime bikarburet vodonika.[17][18] Godine 1833, Ajlhard Mičerlih ga je proizveo destilacijom benzojeve kiseline (iz gumenog benzoina) i krečnjaka. On je nazvao to jedinjenje benzin.[19] Godine 1836, francuski hemičar August Loran je ovu supstancu nazvao „fen” (fr. phène);[20] ta reč je postala koren engleske reči „fenol”, koji je hidroksilovani benzen, i „fenil”, radikal nastao apstrakcijom atoma vodonika (slobodni radikal H•) iz benzena.
Godine 1845, Čarls Mansfild, radeći pod fon Hofmanom, izolovao je benzen iz kamenougljene smole.[21] Četiri godine kasnije, Mansfild je počeo prvu proizvodnju benzena industrijskih razmera, koristeći metod baziran na kamenougljenoj smoli.[22][23] Postepeno se razvio osećaj među hemičarima da su brojne druge supstance hemijski srodne sa benzenom, i da sačinjavaju zasebnu hemijsku familiju. Godine 1855, Hofman je koristio reč „aromatičan” za opisivanje tih porodičnih odnosa, jer je to karakteristično svojstvo mnogih članova te porodice.[24] Godine 1997, benzen je detektovan u dubokom svemiru.[25]
Reference
uredi- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. 10, 22, 204, 494, 577. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). „Solubility of Benzene in Water”. Industrial & Engineering Chemistry Chemical & Engineering Data Series. 3 (2): 253—256. doi:10.1021/i460004a016.
- ^ Breslow, R.; Guo, T. (1990). „Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers”. Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 167—9. Bibcode:1990PNAS...87..167B. PMC 53221 . PMID 2153285. doi:10.1073/pnas.87.1.167.
- ^ Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. str. 114. ISBN 978-0-7506-7766-0. Pristupljeno 31. 05. 2012.
- ^ a b v g d „Benzol”.
- ^ a b Atherton Seidell; William F. Linke (1952). Solubilities of Inorganic and Organic Compounds: A Compilation of Solubility Data from the Periodical Literature. Supplement. Van Nostrand.
- ^ a b v Benzene in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (retrieved 2014-05-29)
- ^ a b v Sigma-Aldrich Co., Benzene. Pristupljeno 29. 5. 2014.
- ^ a b v NIOSH Džepni vodič hemijskih hazarda. „#0049”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ „Benzene”. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ The word "benzoin" is derived from the Arabic expression "luban jawi", or "frankincense of Java". Morris, Edwin T. (1984). Fragrance: The Story of Perfume from Cleopatra to Chanel. Charles Scribner's Sons. str. 101. ISBN 978-0684181950.
- ^ Rocke, A. J. (1985). „Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory”. Annals of Science. 42 (4): 355—81. doi:10.1080/00033798500200411.
- ^ Faraday, M. (1825). „On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat”. Philosophical Transactions of the Royal Society. 115: 440—466. JSTOR 107752. doi:10.1098/rstl.1825.0022. On pages 443–450, Faraday discusses "bicarburet of hydrogen" (benzene). On pages 449–450, he shows that benzene's empirical formula is C6H6, although he doesn't realize it because he (like most chemists at that time) used the wrong atomic mass for carbon (6 instead of 12).
- ^ Kaiser, R. (1968). „Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968”. Angewandte Chemie International Edition in English. 7 (5): 345—350. doi:10.1002/anie.196803451.
- ^ Mitscherlich, E. (1834). „Über das Benzol und die Säuren der Oel- und Talgarten” [On benzol and oily and fatty types of acids]. Annalen der Pharmacie. 9 (1): 39—48. doi:10.1002/jlac.18340090103. In a footnote on page 43, Liebig, the journal's editor, suggested changing Mitscherlich's original name for benzene (namely, "benzin") to "benzol", because the suffix "-in" suggested that it was an alkaloid (e.g., Chinin (quinine)), which benzene isn't, whereas the suffix "-ol" suggested that it was oily, which benzene is. Thus on page 44, Mitscherlich states: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, so gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bittermandelöl isomerische Verbindung von Liebig und Wöhler gewählt worden ist." (Since this liquid [benzene] is obtained from benzoic acid and probably is related to benzoyl compounds, the best name for it is "benzol", since the name "benzoïn" has already been chosen, by Liebig and Wöhler, for the compound that's isomeric with the oil of bitter almonds [benzaldehyde].)
- ^ Laurent, Auguste (1836). „Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique”. Annales de Chemie et de Physique. 63: 27—45., see p. 44: "Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage." (I give the name of "phène" (φαινω, I illuminate) to the fundamental radical of the preceding acids, because benzene is found in illuminating gas.)
- ^ Hofmann, A. W. (1845) "Ueber eine sichere Reaction auf Benzol" (On a reliable test for benzene), Annalen der Chemie und Pharmacie. 55: 200—205. Nedostaje ili je prazan parametar
|title=(pomoć); on pp. 204–205, Hofmann found benzene in coal tar oil. - ^ Mansfield Charles Blachford (1849). „Untersuchung des Steinkohlentheers”. Annalen der Chemie und Pharmacie. 69 (2): 162—180. doi:10.1002/jlac.18490690203.
- ^ Charles Mansfield filed for (November 11, 1847) and received (May 1848) a patent (no. 11,960) for the fractional distillation of coal tar.
- ^ Hoffman, Augustus W. (1856). „On insolinic acid”. Proceedings of the Royal Society. 8: 1—3. doi:10.1098/rspl.1856.0002. „The existence and mode of formation of insolinic acid prove that to the series of monobasic aromatic acids, Cn2Hn2-8O4, the lowest known term of which is benzoic acid, … .” [Note: The empirical formulas of organic compounds that appear in Hofmann's article (p. 3) are based upon an atomic mass of carbon of 6 (instead of 12) and an atomic mass of oxygen of 8 (instead of 16).]
- ^ Cernicharo, José; et al. (1997), „Infrared Space Observatory's Discovery of C4H2, C6H2, and Benzene in CRL 618”, Astrophysical Journal Letters, 546 (2): L123—L126, Bibcode:2001ApJ...546L.123C, doi:10.1086/318871
Literatura
uredi- Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. str. 114. ISBN 978-0-7506-7766-0. Pristupljeno 31. 5. 2012.
- Archibald Scott Couper, On a New Chemical Theory, Philosophical Magazine 16, 104-116 (1858)
- Josef Loschmidt, Chemische Studien I, Carl Gerold's Sohn, Vienna (1861),
- Josef Loschmidt, Chemische Studien I, Aldrich Chemical Co, Milwaukee (1989), catalog no. Z-18576-0, and (1913) catalog no. Z-18577-9
- Kathleen Lonsdale, "The Structure of the Benzene Ring in Hexamethylbenzene" Proceedings of the Royal Society 123A: 494 (1929).
- Lonsdale, Kathleen (Oct. 1, 1931). „An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method”. Proceedings of the Royal Society of London. 133 (822): 536. Bibcode:1931RSPSA.133..536L. doi:10.1098/rspa.1931.0166. Proverite vrednost paramet(a)ra za datum:
|date=(pomoć)
Spoljašnje veze
urediMediji vezani za članak Benzen na Vikimedijinoj ostavi
- ATSDR – Case Studies in Environmental Medicine: Benzene Toxicity
- Benzene
- Benzene Material Safety Data Sheet
- International Chemical Safety Card 0015
- National Pollutant Inventory - Benzene
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph: "Benzene"
- Computational Chemistry Wiki
- Couper and Carbon bonds
- Dept. of Health and Human Services: TR-289: Toxicology and Carcinogenesis Studies of Benzene
- Kekule, Couper and dreams of Benzene Arhivirano na sajtu Wayback Machine (22. maj 2006)
- video podcast (Sir john Cadogan giving a lecture on Benzene since Faraday, in) 1991