Etanol
Etanol ili etil alkohol, alkohol, žesta, špirit, špiritus, je popularno ime za organsko jedinjenje iz grupe alkohola. Pojavljuje se kao bezbojna tečnost prijatnog mirisa.[17] Ime mu dolazi od arapske reči al-kuhl, što znači „prašak za bojanje očnih kapaka”. Proizvodi se najčešće iz skrobnih i šećernih sirovina vrenjem uz pomoć kvasca. Etanol je glavni alkohol u alkoholnim pićima, proizvedenom fermentacijom šećera posredstvom kvasca. On je neurotoksičan[18][19] psihoaktivna materija i jedna od najstarijih rekreacionih droga. On može da uzrokuje alkoholnu intoksikaciju kad se konzumira u prekomernoj količini.

| |||
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| Sistemski IUPAC naziv
etanol[1] | |||
| Drugi nazivi
Apsolutni alkohol, alkohol, parfemski alkohol, etilenski alkohol, EtOH, etil alkohol, etil hidrat, etil hidroksid, etilol, žitačni alkohol, hidroksietan, metilkarbinol, voćni alkohol
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 1718733 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.526 | ||
| Gmelin Referenca | 787 | ||
| UNII | |||
| |||
| |||
| Svojstva | |||
| C2H6O | |||
| Molarna masa | 46,07 g/mol[4] | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Gustina | 0,7893 g/cm³ (на 20 °C)[4] | ||
| Tačka topljenja | −11.414 °C (−20.513 °F; −11.141 K) | ||
| Tačka ključanja | 7.824 ± 009[4] °C (14.115 ± 16 °F; 8.097 ± 9 K) | ||
| meša se | |||
| log P | −0.18 | ||
| Napon pare | 5.95 kPa (na 20 °C) | ||
| Kiselost (pKa) | 15.9 (H2O), 29.8 (DMSO)[5][6] | ||
| Baznost (pKb) | −1.9 | ||
| Magnetna susceptibilnost | -33.60·10−6 cm³/mol | ||
| Indeks refrakcije (nD) | 1.3611[4] | ||
| Viskoznost | 1.2 mPa·s (na 20 °C), 1.074 mPa·s (na 25 °C)[7] | ||
| Dipolni moment | 1.69 D[8] | ||
| Farmakologija | |||
| Klasa lekova | depresant centralnog nervnog sistema | ||
| D08AX08 (WHO) V03AB16, V03AZ01 | |||
| Umerena[16] | |||
| Umerena (10–15%)[15] | |||
| Načini upotrebe | Obično: oralno, topikalno ređe: supozitorno, inhalaciono, okularno, insuflaciono,[9] injekciono[10] | ||
| Farmakokinetika: | |||
| Promenljiva[11] | |||
| Jetra: enzim alkoholna dehidrogenaza | |||
| Acetaldehid, sirćetna kiselina, acetil-KoA, ugljen-dioksid, voda | |||
| konstantna brzina eliminacije[12] | |||
| Urin, daz, znoj, suze, mleko, pljuvačka, žuč[12] | |||
| Legalni status |
| ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
Etan Metanol | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
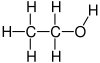
Upotrebljava se za kao rastvarač i sredstvo za ekstrakciju, za dezinfekciju,[20] za konzerviranje i pri proizvodnji alkoholnih pića. Služi kao polazna sirovina za celi niz hemikalija. Opšta formula alkohola je R-O H, dakle hidroksilna grupa O H, vezana na alkan tj. lanac ugljovodonika. Sličnu strukturu imaju karboksilne kiseline koje se dobijaju oksidacijom alkohola. Hidroksilna grupa (funkcionalna grupa) se sastoji od jednog atoma vodonika i jednog atoma kiseonika, prema tome je jednovalentna. Zato i lanac na koji se grupa vezuje mora biti jednovalentan. Tako će npr. sažeta strukturna formula etanola biti CH3-CH2-OH.
Nomenklatura alkohola
urediAlkoholi se imenuju tako da se uz ime alkana doda nastavak -ol. Tako će npr. alkohol s tri ugljikova atoma biti propanol jer se uz ime alkana propana dodao ol od alkohola. Kao osnovna struktura odabere se najduži lanac atoma ugljenika na koji je vezana hidroksilna grupa. Položaj hidroksilne grupe označi se brojem ispred nastavka - ol. Za oznaku broja hidroksilnih skupina koriste se umnožni prefiksi neposredno ispred nastavka - ol.
Hemijska struktura
urediEtanol (formula: C2H5OH) spada u n-alkanole. Izveden je iz alkana etana (C2H6) u kojem je jedan atom vodonika zamenjen hidroksilnom funkcionalnom grupom (OH). Zbog toga je imenu etan dodan sufiks -ol u skladu sa nomenklaturom IUPAC. Naziv etanol se koristi konkretno za ovo hemijsko jedinjenje, dok se alkohol može odnositi na celokupnu grupu hemijskih jedinjenja alkohola u koju spadaju, između ostalih, metanol, propanol, butanol i mnogi drugi.
Fizičke i hemijske osobine
urediNajpoznatiji alkohol koji se koristi u medicini i piću je etanol. Zato je on i najčešći alkohol dobijan industrijskim putem. Hemijska reakcija za dobijanje etanola je alkoholno vrenje ili fermentacija. To je prirodni proces kojim se šećer uz pomoć delovanja kvaščevih gljivica (enzima koji deluju kao katalizatori) pretvara u etanol i CO2.
Etanol je lako isparljiva, zapaljiva providna tečnost specifičnog oštrog mirisa. Temperatura ključanja je 78 °C. Prisutna hidroksilna grupa učestvuje u stvaranju vodoničnih veza uslovljavajući manju isparljivost etanola u odnosu na nepolarna jedinjenja slične molekulske mase. Dobar je rastvarač, meša se sa vodom u svim odnosima, a rastvara veliki broj kako polarnih tako i nepolarnih jedinjenja. Pri mešanju etanola i vode dolazi do kontrakcije zapremine (1 litar etanola i 1 litar vode daju 1,92 litara smeše). Gustina etanola zavisi od temperature, i kreće se od 0,80 g/cm³ na 0 °C do 0,75 g/cm³ na 60 °C. Indeks prelamanja 100%-tnog etanola iznosi nD20=1,3613.
Hemijske osobine etanola iste su kao kod drugih alkohola.
Dobijanje etanola
urediAlkoholno vrenje je najstariji način dobivanja alkohola. To je proces u kojem se uz katalitičko delovanje enzima kvaščevih gljivica ugljeni hidrati pretvaraju u etanol. U pićima se dobije delovanjem kvaščevih gljivica, na šećeru ječmu (za pivo), grožđu (vino), te ječmu, kukuruzu ili riži (viski). Fermentacija se prekida kada je zapreminski udeo alkohola 16% jer koncentriraniji alkohol utiče na aktivnost enzima (gljivica). Pića u kojima je zapreminski udeo alkohola veći, dobiju se destilacijom. Specifičan ukus vina i pića potiče od malih koncentracija dugolančanih ugljovodonika, aldehida, organskih kiselina i estara.
S obzirom na to da ubija kvasac, fermentacijom se ne mogu proizvesti alkoholni rastvori s više od 15% zapreminskog udela etanola.
Alkohol namenjen pripremi alkoholnih pića se proizvodi od skrobnih ili šećernih sirovina vrenjem pomoću kvasca. Industrijskom fermentacijom sirovina bogatih šećerom (melasa, sirutka, šećerna repa, voće), skrobom (krompir, kukuruz, ječam, raž, riža, zob i druge žitarice) ili celulozom (otpadna sulfitna lužina), proizvodi se etanol koji se upotrebljava kao gorivo. Sirovine od kojih se pre vrenja priprema rastvor, nazvana je prema sirovini, skrobna komina (ili slatka komina).
Sirovine se prvo usitne (voće, žitarice, krompir, šećerna repa), po potrebi mešaju s vodom radi suspendovanja (skrobne sirovine) ili razređivanja (melasa). Katkad se dodaju i hranjive soli kao izvori azota i fosfora. Skrobne se komine zagrijavanjem prevode u skrobni lepak, delom ohlade i podvrgavaju enzimskoj hidrolizi.
Dodaju se amilolitički enzimi različitog porekla (nekad zeleni ječmeni slad, danas komercijalni enzimski preparati dobijeni uzgojem mikroorganizama), koji razgrađuju skrob u fermentabilne šećere. Slatka se komina nakon hlađenja prebacuje u fermentore i inokulira kvascem, koji u roku od 36 do 72 sata previre šećere.
Oslobođena toplota se odvodi rashladnim medijem u okolinu, a nastali ugljen-dioksid često se hvata i iskorištava. Prevrela komina, osim etilnog alkohola, sadrži i sporedne proizvode alkoholnoga vrenja. Višekratnom destilacijom alkohol se razdvaja od lakše isparljivog acetaldehida i acetala i od teže isparljivog patočnog ulja, tj. smeše viših alkohola, uglavnom butilnog i amilnog, pa se dobija rafinirani alkohol. Vodena suspenzija iz koje je destilacijom izdvojen alkohol (džibra) služi kao stočna hrana ili (od melase) za dobivanje đubriva i dr.
Frakcionom destilacijom smeše alkohola i vode ne može se dobiti čisti, bezvodni etanol, jer destilacijom nastaje azeotropska smeša sa stalnom tačkom ključanja s masenim udelom 95,6% alkohola i 4,4% vode, koja ima pri 78,15 °C konstantnu tačku ključanja (azeotropna smješa), koje je niže od tačke ključanja čistog alkohola. Zbog toga je običan alkohol zapravo smeša od približno 95% etilng alkohola, a ostatak uglavnom čini voda. Voda u alkoholu smanjuje njegovu sposobnost rastvaranja.
Za dobivanje čistog etanola (bezvodnog ili apsolutnog alkohola, gde je udeo alkohola 99% ili veći) s najviše 1% vode u sebi, treba se pri destilaciji ukloniti vodu sredstvima za sušenje (npr. kalcijum oksid je jeftina materija koja najbolje veže vodu) ili koje isparavanjem odnose sa sobom u parama azeotropnog sastava, uz ponešto alkohola, i svu vodu (npr. benzen).
Industrijsko dobijanje etanola
urediAlkohol se najčešće dobija alkoholnim vrenjem šećera, a dobijeni etanol se označava kao agrar- ili bioetanol. Ograničavajući faktor u dobijanju bioetanola je otpornost mikroorganizama koji ga proizvode (kvasac ugine pri koncentraciji etanola od 18%) pa je za dobijanje žestokih alkoholnih pića neophodna redestilacija. Etanol se može proizvesti i sintezom iz vode i etena u prisustvu sumporne kiseline kao katalizatora.
Smeša 95,57% etanola i 4,43% vode čini azeotropnu smešu, pa se veća koncentracija etnola ne može dobiti destilacijom pri atmosferskom pritisku, već se za dobijanje 100% (apsolutnog) etanola koriste druge metode.
- CH2=CH2 + H2O (uz katalizator, tlak = 200 bar, temperatura = 300 °C) → CH3-CH2-OH
Vino i fermentacija
urediVinogradarstvo je grana poljoprivrede koja postoji od davnina, a kultura proizvodnje vina održala se vekovima. Proces proizvodnje vina je sledeći: Ubrano grožđe iz vinograda se prvo gazi tako da se iscedi sok a kasnije se ljuska odvaja od tečnosti (Ljuska se može iskoristiti za pravljenje rakije ili sl.). Tečna - „mošt” (koja je većim postotkom šećer) se ostavlja u bačvama gde se na određenoj temperaturi uz delovanje kvaščevih gljivica fermentira (događa se alkoholno vrenje ili fermentacija). Tako se šećer pretvara u alkohol i tečnost postaje vino. Napomena: Nekoliko nedelja prije procesa traje period karence. U tom se periodu grožđe ne sme prskati pesticidima, jer bi na taj način dospjeli u vino.
Farmakologija
urediEtanol modifikuje ponašanje ljudi pa spada u psihoaktivne supstance.
Etanol se resorbuje iz želuca i tankog creva odakle dospeva u jetru. Na resorpciju alkohola utiče unos druge hrane i pića (masti umanjuju brzinu resorpcije, dok je gazirana pića ubrzavaju). Prilikom unosa, etanol može oštetiti sluzokožu želuca, rastvaranjem mukusnog sloja koji je štiti od dejstva hlorovodonične kiseline. Pri prolazu kroz jetru alkoholna dehidrogenaza oksidiše etanol do acetaldehida. Acetaldehid izaziva različite neprijatne efekte, ali ga acetaldehidna dehidrogenaza odmah prevodi u neškodljivu sirćetnu kiselinu. Normalno, acetaldehid se mnogo brže prevodi u sirćetnu kiselinu nego što se stvara, ali u slučaju genetskih poremećaja (neostatak acetaldehidne dehidrogenaze ili superefikasna alkoholna dehidrogenaza) ili primene nekih lekova koji se koriste za lečenje alkoholizma (disulfiram), dolazi do njegovog nagomilavanja i ispoljavanja štetnih efekata (koja se manifestuju kao mamurluk).
Etanol prolazi kroz hematoencefalnu barijeru i umanjuje inhibicije. Mehanizam dejstva nije u potpunosti rasvetljen, ali se čini da ne postoji poseban receptor za etanol, već da dolazi do promene fizičkohemijskih osobina ćelijske membrane neurona. Osim dezinhibicije, etanol usporava reflekse, smanjuje olfaktornu percepciju, a dejstvom na očni nerv dovodi do diplopije, utiče na kretanje i fine motorne radnje (uključujući i govor).
Etanol se izlučuje putem pluća (što se koristi u određivanju koncentracije alkohola u krvi), urina, a delom se uključuje u Krebsov ciklus i prevodi u ugljen-dioksid.
Upotreba
urediAlkoholna pića
urediEtanol je glavni sastojak alkoholnih pića, u kojima se nalazi u koncentraciji od 3 do 40%. U većini zemalja zabranjena je prodaja alkoholnih pića maloletnim osobama, a i vodeće svetske religije zabranjuju upotrebu alkoholnih pića (islam, hinduizam, većina budističkih škola, neke protestantske crkve, mormoni i dr.). Osnovni razlog zabrane je moguća zloupotreba. Pokazano je da ograničena upotreba alkoholnih pića moće imati pozitivan uticaj na zdravlje (npr. prevencija hipertenzije).
Alkohol se može pronaći prirodno u zrelom voću kao proizvod alkoholnog vrenja voćnog šećera. Količine alkohola u različitim proizvodima (u volumenskom udelu):
- hleb: do 0,3%
- sok od jabuke: do 0,4%
- bezalkoholno pivo: do 0,5%
- sok od grožđa: do 0,6%
- zrela banana: do 1%
- kefir: do 1%
- pivo
- svetlo pivo: 1-2,5%
- puno pivo: 3-5%
- jako pivo: 6-12%
- vino: uglavnom od 7-14%
- vino od meda: 5-15%
- vino od jabuke: 5,5-7%
- liker: 15-75%, većinom ispod 30%
- špirit: od 30-80%, većinom oko 40%
Upotreba u medicini
urediEtanol je visokoefikasan antiseptik u koncentracija od 70%. Antiseptičko dejstvo ostvaruje denaturacijom ćelijskih membrana, pa je efikasniji kao 70%-ni nego kao koncentrovani (96%). Koristi se za dezinfekciju radnih površina, instrumenata i kože. Mada se koristi i za dezinfekciju rana, preporučuje se da se rane dezinfikuju vodonik-peroksidom koji uništava anaerobne bakterije, uključujući bacil tetanusa.
Alkoholne obloge koriste se za smanjenje povišene telesne temperature. Upotreba alkoholnih obloga kod dece se ne preporučuje jer deca nemaju razvijenu kožu pa je moguća resorpcija etanola preko kože.[21]
Etanol se koristi kao protivotrov kod trovanja metanolom jer kompetitivnom inhibicijom sprečava prevođenje metanola u formaldehid i dalje do mravlje kiseline.[22]
Etanol kao gorivo
urediVećina od 20 miliona vozača u Brazilu koristi automobilsko gorivo u kome ima 25% etanola.[23] Cena etanola je više nego dvostruko niža od cene od benzina ili dizela i u Brazilu se to gorivo može nabaviti širom zemlje.[24] O Brazilu se sve češće govori kao o etalonskoj Saudijskoj Arabiji. Sve je veći broj zemalja koje sada propisuju kombinovanje biogoriva sa standardnim fosilnim gorivima. A velike petrohemijske kompanije kao što su „Šel” (Shell) sve više ulažu u tu tehnologiju.
Zahvaljujući skokovitom porastu cena nafte, brizi zbog klimatskih promena i i rastućem strahu za bezbednost snabdevanja sirovom naftom etanolu i drugim vrstama biogoriva predstoji svetla budućnost. Biogoriva koja će se u budućnosti bazirati na drvenastim biljkama a ne na kukuruzu, zahtevaće krupna ulaganja, ali će se ulaganje brzo isplatiti: poljoprivreda će oživeti, obradivo zemljište će biti zaštićeno, vodotoci će biti sačuvani.[25]
Postoji nekoliko klasa goriva koje sadrže etanol:[26]||26.8[26]
- E5 sadrži 5% etanola i 95% benzina. Ima oktansku vrednost od RON95 oktana. Koristi se bez ikakvih izmena na benzinskim automobilima.
- E85 sadrži 85% etanola, 14% benzina i 1% aditiva koji izazivaju povraćanje. Ima oktansku vrednost od RON104 oktana. Da bi se koristilo u automobilima potrebno je dodati motoru 40% više E85 u odnosu na benzin. Ovo se postiže stavljanjem većih brizgaljki umesto originalnih. Radni opseg goriva je -25 °C do +78 °C spoljne temperature. Kod nas ga još nema na pumpama zbog neizgrađene infrastrukture. Mana: veća potrošnja E85 ca 30% u odnosu na gorivo.
- E96 sadrži 96% etanola i 4% vode. Ima oktansku vrednost od RON118 oktana. Da bi se koristilo u automobilima potrebno je dodati motoru 50% više E96 u odnosu na benzin. Ovo se postiže stavljanjem većih brizgaljki umesto originalnih. Radni opseg goriva je +13 °C do +78 °C spoljne temperature, dakle zimi je potrebno predzagrejavanje i vazduha i goriva te se u praksi koristi samo kao ljetnje gorivo. Ima odlična rashladna svojstva, bolji stepen iskorištenja i čistije izduvne gasove u odnosu na benzin. Cena u EU je oko 5€/litar. Mana: veća potrošnja od ca 40% u odnosu na gorivo te je akcioni radijus automobila kraći.
Etanol kvaliteta E96 se može dobiti na više načina i to:
- Destilacijom i fermentacijom voća, povrća i biološkog otpada (neefikasno i skupo). Ovaj proces je u narodu dobro poznat kao tradicionalno pečenje rakije tj prepečenice.
- Ekstrakcijom iz zemnog gasa metana CH4 (industrijska primena korištena niz godina).
- Sintezom ugljen-dioksida i vodoničnog gasa uz pomoć MoS2 ili sličnog katalizatora.
- 2CO2+6H2=C2H5OH
Ovaj proces se vrši na temperaturama od preko 255 °C.
Zloupotreba alkohola
urediPrekomerna upotreba alkoholnih pića dovodi do niza psihičkih i fizičkih poremećaja praćenih pojavom fizičke zavisnosti. Ovi simptomi obuhvaćeni su pojmom alkoholizam. Od posledice prekomernog unosa alkohola najčešće strada jetra (ciroza, masna degeneracija jetre). Etanol prolazi placentalnu barijeru i dospeva u krv fetusa, uzrokujući brojne poremećaje u organogenezi uključujući pojavu smanjenog mozga mikrocefalija.
Države povremeno pokušavaju da ograniče ili potpuno zabrane prodaju alkoholnih pića. SAD su uvele prohibiciju tokom velike ekonomske krize, a u Rusiji je nakon sloma komunizma bila zabranjena prodaja alkoholnih pića do 18č.
Istorija
urediPrvi put čisti etanol je dobio persijski lekar, naučnik, filozof i pisac Ebu Bekr Muhamed Ibn Zekerija al-Razi putem destilacije vina. Nazvao ga je al-kuhl. Ukazao je na sterilizirajuće i dezinfekcijske osobine alkohola i upotrebljavao ga u medicinske svrhe.
U arapskom jeziku الكحل [al-kuhul] se doslovno koristio kao naziv za šminku (za oči) i prah (antimona), a koristio se kao rastvarač. Kasnije je ovaj naziv došao u Evropu preko Španije tokom arapskog osvajanja. U španskom jeziku reč alcohol (arap. الكحول [al-kahla]) se prvobitno koristila za fini, suhi prah, koji su upotrebljavali alhemičari.
Reference
uredi- ^ „Ethanol – Compound Summary”. The PubChem Project. USA: National Center for Biotechnology Information.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ a b v g Haynes, William M., ur. (2011). CRC Handbook of Chemistry and Physics (92nd izd.). Boca Raton, FL: CRC Press. str. 3.246. ISBN 1439855110.
- ^ Ballinger, P.; Long, F. A. (1960). „Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds1,2”. Journal of the American Chemical Society. 82 (4): 795—798. doi:10.1021/ja01489a008.
- ^ Arnett, E. M.; Venkatasubramaniam, K. G. (1983). „Thermochemical acidities in three superbase systems”. J. Org. Chem. 48 (10): 1569—1578. doi:10.1021/jo00158a001.
- ^ Lide, David R., ur. (2012). CRC Handbook of Chemistry and Physics (92 izd.). Boca Raton, FL.: CRC Press/Taylor and Francis. str. 6—232.
- ^ Lide, David R., ur. (2008). CRC Handbook of Chemistry and Physics (89 izd.). Boca Raton: CRC Press. str. 9-55.
- ^ Stogner, John M.; Eassey, John M.; Baldwin, Julie Marie; Miller, Bryan Lee (2014). „Innovative alcohol use: Assessing the prevalence of alcohol without liquid and other non-oral routes of alcohol administration”. Drug and Alcohol Dependence. 142: 74—78. PMID 25012895. doi:10.1016/j.drugalcdep.2014.05.026.
- ^ Gilman, Jodi M.; Ramchandani, Vijay A.; Crouss, Tess; Hommer, Daniel W. (28. 9. 2011). „Subjective and Neural Responses to Intravenous Alcohol in Young Adults with Light and Heavy Drinking Patterns”. Neuropsychopharmacology. 37 (2): 2011206. PMID 21956438. doi:10.1038/n.
- ^ Swift, Robert (2003). „Direct measurement of alcohol and its metabolites”. Addiction. 98: 73—80. PMID 14984244. doi:10.1046/j.1359-6357.2003.00605.x.
- ^ a b Becker, CE (12. 8. 2013). „The Clinical Pharmacology of Alcohol”. California Medicine. 113 (3): 37—45. PMC 1501558 . PMID 5457514.
- ^ Schmidt, Alexander (1974), Memorandum of Understanding Between The Bureau of Alcohol, Tobacco and Firearms and The Food and Drug Administration regarding the Promulgation and Enforcement of the Labeling Regulations Promulgated under the Federal Alcohol Administration Act, Washington, D.C.: Food and Drug Administration, Pristupljeno 24. 6. 2015
- ^ „Alcohol”. Drugs.com. Pristupljeno 7. 7. 2015.
- ^ Vengeliene, V.; Bilbao, A; Molander, A; Spanagel, R (2008). „Neuropharmacology of alcohol addiction”. British Journal of Pharmacology. 154 (2): 299—315. PMC 2442440 . PMID 18311194. doi:10.1038/bjp.2008.30. „(Compulsive alcohol use) occurs only in a limited proportion of about 10–15% of alcohol users....”
- ^ WHO Expert Committee on Problems Related to Alcohol Consumption : second report. (PDF). Geneva, Switzerland: World Health Organization. 2007. str. 23. ISBN 9789241209441. Pristupljeno 3. 3. 2015. „.alcohol dependence (is) a substantial risk of regular heavy drinking...”
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ „10th Special Report to the U.S. Congress on Alcohol and Health: Highlights from Current Research” (PDF). National Institute of Health. National Institute on Alcohol Abuse and Alcoholism. 2000. str. 134. Arhivirano iz originala (PDF) 21. 02. 2016. g. Pristupljeno 21. 10. 2014. „The brain is a major target for the actions of alcohol, and heavy alcohol consumption has long been associated with brain damage. Studies clearly indicate that alcohol is neurotoxic, with direct effects on nerve cells. Chronic alcohol abusers are at additional risk for brain injury from related causes, such as poor nutrition, liver disease, and head trauma.”
- ^ Brust, J. C. M. (2010). „Ethanol and Cognition: Indirect Effects, Neurotoxicity and Neuroprotection: A Review”. International Journal of Environmental Research and Public Health. 7 (4): 1540—57. PMC 2872345 . PMID 20617045. doi:10.3390/ijerph7041540.
- ^ McDonnell G, Russell AD; Russell (1999). „Antiseptics and disinfectants: activity, action, and resistance”. Clin. Microbiol. Rev. 12 (1): 147—79. PMC 88911 . PMID 9880479.
- ^ Calesnick, B.; Vernick, H. (1971). „Antitussive activity of ethanol”. Q J Stud Alcohol. 32 (2): 434—441. PMID 4932255.
- ^ „Methanol poisoning”. MedlinePlus. National Institute of Health. 30. 1. 2013. Pristupljeno 6. 4. 2015.
- ^ Appendix B, Transportation Energy Data Book from the Center for Transportation Analysis of the Oak Ridge National Laboratory
- ^ Reel, M. (August 19, 2006) "Brazil's Road to Energy Independence", The Washington Post.
- ^ Green, Ray. „Model T Ford Club Australia (Inc.)”. Arhivirano iz originala 14. 1. 2014. g. Pristupljeno 24. 6. 2011.
- ^ a b Thomas, George: Overview of Storage Development DOE Hydrogen Program. Livermore, CA. Sandia National Laboratories. 2000.
Literatura
uredi- WHO Expert Committee on Problems Related to Alcohol Consumption : second report. (PDF). Geneva, Switzerland: World Health Organization. 2007. str. 23. ISBN 9789241209441. Pristupljeno 3. 3. 2015. „.alcohol dependence (is) a substantial risk of regular heavy drinking...”
- Onuki, Shinnosuke; Koziel, Jacek A.; van Leeuwen, Johannes; Jenks, William S.; Grewell, David; Cai, Lingshuang (2008). Ethanol production, purification, and analysis techniques: a review. 2008 ASABE Annual International Meeting. Providence, RI. Pristupljeno 16. 2. 2013.
- Smith, M.G., and M. Snyder. (2005). "Ethanol-induced virulence of Acinetobacter baumannii". American Society for Microbiology meeting. Volume 1 June 5 – June 9. Atlanta.
- The National Institute on Alcohol Abuse and Alcoholism maintains a database of alcohol-related health effects. ETOH Archival Database (1972–2003) Alcohol and Alcohol Problems Science Database.
- Boyce, John M., and Pittet Didier. (2003). "Hand Hygiene in Healthcare Settings". Centers for Disease Control, Atlanta, Georgia, United States.
- Sci-toys website explanation of US denatured alcohol designations
- Norman L. Allinger, Michael P. Cava, Don C. de Jongh, Carl R. Johnson, Norman A. Lebel, Calvin L. Stevens: Organische Chemie. 1. izdanje, Walter de Gruyter. . Berlin. 1980. str. 125—127. ISBN 978-3-11-004594-9. Nedostaje ili je prazan parametar
|title=(pomoć). - Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 19. izdanje, S. Hirzel Verlag, Stuttgart. 1981. ISBN 978-3-7776-0356-8. str. 115-117..
- Robert T. Morrison, Robert N. Boyd: Lehrbuch der Organischen Chemie. 3. izdanje, VCH, Weinheim. 1986. ISBN 978-3-527-26067-6. str. 526-527..
- Beilstein: Handbuch der Organischen Chemie. 1. Band. стр. 292–314 (ext. Link).
Spoljašnje veze
uredi- Alcohol (Ethanol) at The Periodic Table of Videos (University of Nottingham)
- International Labour Organization ethanol safety information
- National Pollutant Inventory – Ethanol Fact Sheet
- CDC – NIOSH Pocket Guide to Chemical Hazards – Ethyl Alcohol
- National Institute of Standards and Technology chemical data on ethanol
- ChEBI – biology related
- Chicago Board of Trade news and market data on ethanol futures
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of ethanol
- Ethanol History A look into the history of ethanol
- ChemSub Online: Ethyl alcohol
- Industrial ethanol production process flow diagram using ethylene and sulphuric acid