Етанол
Етанол или етил алкохол, алкохол, жеста, шпирит, шпиритус, је популарно име за органско једињење из групе алкохола. Појављује се као безбојна течност пријатног мириса.[17] Име му долази од арапске речи al-kuhl, што значи „прашак за бојање очних капака”. Производи се најчешће из скробних и шећерних сировина врењем уз помоћ квасца. Етанол је главни алкохол у алкохолним пићима, произведеном ферментацијом шећера посредством квасца. Он је неуротоксичан[18][19] психоактивна материја и једна од најстаријих рекреационих дрога. Он може да узрокује алкохолну интоксикацију кад се конзумира у прекомерној количини.

| |||
| |||
| |||
| Називи | |||
|---|---|---|---|
| Системски IUPAC назив
етанол[1] | |||
| Други називи
Апсолутни алкохол, алкохол, парфемски алкохол, етиленски алкохол, EtOH, етил алкохол, етил хидрат, етил хидроксид, етилол, житачни алкохол, хидроксиетан, метилкарбинол, воћни алкохол
| |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| Бајлштајн | 1718733 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.526 | ||
| Гмелин Референца | 787 | ||
| UNII | |||
| |||
| |||
| Својства | |||
| C2H6O | |||
| Моларна маса | 46,07 g/mol[4] | ||
| Агрегатно стање | Безбојна течност | ||
| Густина | 0,7893 g/cm³ (на 20 °C)[4] | ||
| Тачка топљења | −11.414 °C (−20.513 °F; −11.141 K) | ||
| Тачка кључања | 7.824 ± 009[4] °C (14.115 ± 16 °F; 8.097 ± 9 K) | ||
| меша се | |||
| log P | −0.18 | ||
| Напон паре | 5.95 kPa (на 20 °C) | ||
| Киселост (pKa) | 15.9 (H2O), 29.8 (ДМСО)[5][6] | ||
| Базност (pKb) | −1.9 | ||
| Магнетна сусцептибилност | -33.60·10−6 cm³/mol | ||
| Индекс рефракције (nD) | 1.3611[4] | ||
| Вискозност | 1.2 mPa·s (на 20 °C), 1.074 mPa·s (на 25 °C)[7] | ||
| Диполни момент | 1.69 D[8] | ||
| Фармакологија | |||
| Класа лекова | депресант централног нервног система | ||
| D08AX08 (WHO) V03AB16, V03AZ01 | |||
| Умерена[16] | |||
| Умерена (10–15%)[15] | |||
| Начини употребе | Обично: орално, топикално ређе: супозиторно, инхалационо, окуларно, инсуфлационо,[9] инјекционо[10] | ||
| Фармакокинетика: | |||
| Променљива[11] | |||
| Јетра: ензим алкохолна дехидрогеназа | |||
| Ацеталдехид, сирћетна киселина, ацетил-КоА, угљен-диоксид, вода | |||
| константна брзина елиминације[12] | |||
| Урин, даз, зној, сузе, млеко, пљувачка, жуч[12] | |||
| Легални статус |
| ||
| Сродна једињења | |||
Сродна једињења
|
Етан Метанол | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
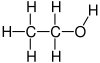
Употребљава се за као растварач и средство за екстракцију, за дезинфекцију,[20] за конзервирање и при производњи алкохолних пића. Служи као полазна сировина за цели низ хемикалија. Општа формула алкохола је R-O H, дакле хидроксилна група O H, везана на алкан тј. ланац угљоводоника. Сличну структуру имају карбоксилне киселине које се добијају оксидацијом алкохола. Хидроксилна група (функционална група) се састоји од једног атома водоника и једног атома кисеоника, према томе је једновалентна. Зато и ланац на који се група везује мора бити једновалентан. Тако ће нпр. сажета структурна формула етанола бити CH3-CH2-OH.
Номенклатура алкохола
уредиАлкохоли се именују тако да се уз име алкана дода наставак -ол. Тако ће нпр. алкохол с три угљикова атома бити пропанол јер се уз име алкана пропана додао ол од алкохола. Као основна структура одабере се најдужи ланац атома угљеника на који је везана хидроксилна група. Положај хидроксилне групе означи се бројем испред наставка - ол. За ознаку броја хидроксилних скупина користе се умножни префикси непосредно испред наставка - ол.
Хемијска структура
уредиЕтанол (формула: C2H5OH) спада у n-алканоле. Изведен је из алкана етана (C2H6) у којем је један атом водоника замењен хидроксилном функционалном групом (OH). Због тога је имену етан додан суфикс -ол у складу са номенклатуром IUPAC. Назив етанол се користи конкретно за ово хемијско једињење, док се алкохол може односити на целокупну групу хемијских једињења алкохола у коју спадају, између осталих, метанол, пропанол, бутанол и многи други.
Физичке и хемијске особине
уредиНајпознатији алкохол који се користи у медицини и пићу је етанол. Зато је он и најчешћи алкохол добијан индустријским путем. Хемијска реакција за добијање етанола је алкохолно врење или ферментација. То је природни процес којим се шећер уз помоћ деловања квашчевих гљивица (ензима који делују као катализатори) претвара у етанол и CO2.
Етанол је лако испарљива, запаљива провидна течност специфичног оштрог мириса. Температура кључања је 78 °C. Присутна хидроксилна група учествује у стварању водоничних веза условљавајући мању испарљивост етанола у односу на неполарна једињења сличне молекулске масе. Добар је растварач, меша се са водом у свим односима, а раствара велики број како поларних тако и неполарних једињења. При мешању етанола и воде долази до контракције запремине (1 литар етанола и 1 литар воде дају 1,92 литара смеше). Густина етанола зависи од температуре, и креће се од 0,80 g/cm³ на 0 °C до 0,75 g/cm³ на 60 °C. Индекс преламања 100%-тног етанола износи nD20=1,3613.
Хемијске особине етанола исте су као код других алкохола.
Добијање етанола
уредиАлкохолно врење је најстарији начин добивања алкохола. То је процес у којем се уз каталитичко деловање ензима квашчевих гљивица угљени хидрати претварају у етанол. У пићима се добије деловањем квашчевих гљивица, на шећеру јечму (за пиво), грожђу (вино), те јечму, кукурузу или рижи (виски). Ферментација се прекида када је запремински удео алкохола 16% јер концентриранији алкохол утиче на активност ензима (гљивица). Пића у којима је запремински удео алкохола већи, добију се дестилацијом. Специфичан укус вина и пића потиче од малих концентрација дуголанчаних угљоводоника, алдехида, органских киселина и естара.
С обзиром на то да убија квасац, ферментацијом се не могу произвести алкохолни раствори с више од 15% запреминског удела етанола.
Алкохол намењен припреми алкохолних пића се производи од скробних или шећерних сировина врењем помоћу квасца. Индустријском ферментацијом сировина богатих шећером (меласа, сирутка, шећерна репа, воће), скробом (кромпир, кукуруз, јечам, раж, рижа, зоб и друге житарице) или целулозом (отпадна сулфитна лужина), производи се етанол који се употребљава као гориво. Сировине од којих се пре врења припрема раствор, названа је према сировини, скробна комина (или слатка комина).
Сировине се прво уситне (воће, житарице, кромпир, шећерна репа), по потреби мешају с водом ради суспендовања (скробне сировине) или разређивања (меласа). Каткад се додају и храњиве соли као извори азота и фосфора. Скробне се комине загријавањем преводе у скробни лепак, делом охладе и подвргавају ензимској хидролизи.
Додају се амилолитички ензими различитог порекла (некад зелени јечмени слад, данас комерцијални ензимски препарати добијени узгојем микроорганизама), који разграђују скроб у ферментабилне шећере. Слатка се комина након хлађења пребацује у ферменторе и инокулира квасцем, који у року од 36 до 72 сата превире шећере.
Ослобођена топлота се одводи расхладним медијем у околину, а настали угљен-диоксид често се хвата и искориштава. Преврела комина, осим етилног алкохола, садржи и споредне производе алкохолнога врења. Вишекратном дестилацијом алкохол се раздваја од лакше испарљивог ацеталдехида и ацетала и од теже испарљивог паточног уља, тј. смеше виших алкохола, углавном бутилног и амилног, па се добија рафинирани алкохол. Водена суспензија из које је дестилацијом издвојен алкохол (џибра) служи као сточна храна или (од меласе) за добивање ђубрива и др.
Фракционом дестилацијом смеше алкохола и воде не може се добити чисти, безводни етанол, јер дестилацијом настаје азеотропска смеша са сталном тачком кључања с масеним уделом 95,6% алкохола и 4,4% воде, која има при 78,15 °C константну тачку кључања (азеотропна смјеша), које је ниже од тачке кључања чистог алкохола. Због тога је обичан алкохол заправо смеша од приближно 95% етилнг алкохола, а остатак углавном чини вода. Вода у алкохолу смањује његову способност растварања.
За добивање чистог етанола (безводног или апсолутног алкохола, где је удео алкохола 99% или већи) с највише 1% воде у себи, треба се при дестилацији уклонити воду средствима за сушење (нпр. калцијум оксид је јефтина материја која најбоље веже воду) или које испаравањем односе са собом у парама азеотропног састава, уз понешто алкохола, и сву воду (нпр. бензен).
Индустријско добијање етанола
уредиАлкохол се најчешће добија алкохолним врењем шећера, а добијени етанол се означава као аграр- или биоетанол. Ограничавајући фактор у добијању биоетанола је отпорност микроорганизама који га производе (квасац угине при концентрацији етанола од 18%) па је за добијање жестоких алкохолних пића неопходна редестилација. Етанол се може произвести и синтезом из воде и етена у присуству сумпорне киселине као катализатора.
Смеша 95,57% етанола и 4,43% воде чини азеотропну смешу, па се већа концентрација етнола не може добити дестилацијом при атмосферском притиску, већ се за добијање 100% (апсолутног) етанола користе друге методе.
- CH2=CH2 + H2O (uz katalizator, tlak = 200 bar, temperatura = 300 °C) → CH3-CH2-OH
Вино и ферментација
уредиВиноградарство је грана пољопривреде која постоји од давнина, а култура производње вина одржала се вековима. Процес производње вина је следећи: Убрано грожђе из винограда се прво гази тако да се исцеди сок а касније се љуска одваја од течности (Љуска се може искористити за прављење ракије или сл.). Течна - „мошт” (која је већим постотком шећер) се оставља у бачвама где се на одређеној температури уз деловање квашчевих гљивица ферментира (догађа се алкохолно врење или ферментација). Тако се шећер претвара у алкохол и течност постаје вино. Напомена: Неколико недеља прије процеса траје период каренце. У том се периоду грожђе не сме прскати пестицидима, јер би на тај начин доспјели у вино.
Фармакологија
уредиЕтанол модификује понашање људи па спада у психоактивне супстанце.
Етанол се ресорбује из желуца и танког црева одакле доспева у јетру. На ресорпцију алкохола утиче унос друге хране и пића (масти умањују брзину ресорпције, док је газирана пића убрзавају). Приликом уноса, етанол може оштетити слузокожу желуца, растварањем мукусног слоја који је штити од дејства хлороводоничне киселине. При пролазу кроз јетру алкохолна дехидрогеназа оксидише етанол до ацеталдехида. Ацеталдехид изазива различите непријатне ефекте, али га ацеталдехидна дехидрогеназа одмах преводи у нешкодљиву сирћетну киселину. Нормално, ацеталдехид се много брже преводи у сирћетну киселину него што се ствара, али у случају генетских поремећаја (неостатак ацеталдехидне дехидрогеназе или суперефикасна алкохолна дехидрогеназа) или примене неких лекова који се користе за лечење алкохолизма (дисулфирам), долази до његовог нагомилавања и испољавања штетних ефеката (која се манифестују као мамурлук).
Етанол пролази кроз хематоенцефалну баријеру и умањује инхибиције. Механизам дејства није у потпуности расветљен, али се чини да не постоји посебан рецептор за етанол, већ да долази до промене физичкохемијских особина ћелијске мембране неурона. Осим дезинхибиције, етанол успорава рефлексе, смањује олфакторну перцепцију, a дејством на очни нерв доводи до диплопије, утиче на кретање и фине моторне радње (укључујући и говор).
Етанол се излучује путем плућа (што се користи у одређивању концентрације алкохола у крви), урина, а делом се укључује у Кребсов циклус и преводи у угљен-диоксид.
Употреба
уредиАлкохолна пића
уредиЕтанол је главни састојак алкохолних пића, у којима се налази у концентрацији од 3 до 40%. У већини земаља забрањена је продаја алкохолних пића малолетним особама, а и водеће светске религије забрањују употребу алкохолних пића (ислам, хиндуизам, већина будистичких школа, неке протестантске цркве, мормони и др.). Основни разлог забране је могућа злоупотреба. Показано је да ограничена употреба алкохолних пића моће имати позитиван утицај на здравље (нпр. превенција хипертензије).
Алкохол се може пронаћи природно у зрелом воћу као производ алкохолног врења воћног шећера. Количине алкохола у различитим производима (у волуменском уделу):
- хлеб: до 0,3%
- сок од јабуке: до 0,4%
- безалкохолно пиво: до 0,5%
- сок од грожђа: до 0,6%
- зрела банана: до 1%
- кефир: до 1%
- пиво
- светло пиво: 1-2,5%
- пуно пиво: 3-5%
- јако пиво: 6-12%
- вино: углавном од 7-14%
- вино од меда: 5-15%
- вино од јабуке: 5,5-7%
- ликер: 15-75%, већином испод 30%
- шпирит: од 30-80%, већином око 40%
Употреба у медицини
уредиЕтанол је високоефикасан антисептик у концентрација од 70%. Антисептичко дејство остварује денатурацијом ћелијских мембрана, па је ефикаснији као 70%-ни него као концентровани (96%). Користи се за дезинфекцију радних површина, инструмената и коже. Мада се користи и за дезинфекцију рана, препоручује се да се ране дезинфикују водоник-пероксидом који уништава анаеробне бактерије, укључујући бацил тетануса.
Алкохолне облоге користе се за смањење повишене телесне температуре. Употреба алкохолних облога код деце се не препоручује јер деца немају развијену кожу па је могућа ресорпција етанола преко коже.[21]
Етанол се користи као противотров код тровања метанолом јер компетитивном инхибицијом спречава превођење метанола у формалдехид и даље до мравље киселине.[22]
Етанол као гориво
уредиВећина од 20 милиона возача у Бразилу користи аутомобилско гориво у коме има 25% етанола.[23] Цена етанола је више него двоструко нижа од цене од бензина или дизела и у Бразилу се то гориво може набавити широм земље.[24] О Бразилу се све чешће говори као о еталонској Саудијској Арабији. Све је већи број земаља које сада прописују комбиновање биогорива са стандардним фосилним горивима. А велике петрохемијске компаније као што су „Шел” (Shell) све више улажу у ту технологију.
Захваљујући скоковитом порасту цена нафте, бризи због климатских промена и и растућем страху за безбедност снабдевања сировом нафтом етанолу и другим врстама биогорива предстоји светла будућност. Биогорива која ће се у будућности базирати на дрвенастим биљкама а не на кукурузу, захтеваће крупна улагања, али ће се улагање брзо исплатити: пољопривреда ће оживети, обрадиво земљиште ће бити заштићено, водотоци ће бити сачувани.[25]
Постоји неколико класа горива које садрже етанол:[26]||26.8[26]
- Е5 садржи 5% етанола и 95% бензина. Има октанску вредност од RON95 октана. Користи се без икаквих измена на бензинским аутомобилима.
- Е85 садржи 85% етанола, 14% бензина и 1% адитива који изазивају повраћање. Има октанску вредност од RON104 октана. Да би се користило у аутомобилима потребно је додати мотору 40% више Е85 у односу на бензин. Ово се постиже стављањем већих бризгаљки уместо оригиналних. Радни опсег горива је -25 °C до +78 °C спољне температуре. Код нас га још нема на пумпама због неизграђене инфраструктуре. Мана: већа потрошња Е85 ца 30% у односу на гориво.
- Е96 садржи 96% етанола и 4% воде. Има октанску вредност од RON118 октана. Да би се користило у аутомобилима потребно је додати мотору 50% више Е96 у односу на бензин. Ово се постиже стављањем већих бризгаљки уместо оригиналних. Радни опсег горива је +13 °C до +78 °C спољне температуре, дакле зими је потребно предзагрејавање и ваздуха и горива те се у пракси користи само као љетње гориво. Има одлична расхладна својства, бољи степен искориштења и чистије издувне гасове у односу на бензин. Цена у ЕУ је око 5€/литар. Мана: већа потрошња од ca 40% у односу на гориво те је акциони радијус аутомобила краћи.
Етанол квалитета Е96 се може добити на више начина и то:
- Дестилацијом и ферментацијом воћа, поврћа и биолошког отпада (неефикасно и скупо). Овај процес је у народу добро познат као традиционално печење ракије тј препеченице.
- Екстракцијом из земног гаса метана CH4 (индустријска примена кориштена низ година).
- Синтезом угљен-диоксида и водоничног гаса уз помоћ MoS2 или сличног катализатора.
- 2CO2+6H2=C2H5OH
Овај процес се врши на температурама од преко 255 °C.
Злоупотреба алкохола
уредиПрекомерна употреба алкохолних пића доводи до низа психичких и физичких поремећаја праћених појавом физичке зависности. Ови симптоми обухваћени су појмом алкохолизам. Од последице прекомерног уноса алкохола најчешће страда јетра (цироза, масна дегенерација јетре). Етанол пролази плаценталну баријеру и доспева у крв фетуса, узрокујући бројне поремећаје у органогенези укључујући појаву смањеног мозга микроцефалија.
Државе повремено покушавају да ограниче или потпуно забране продају алкохолних пића. САД су увеле прохибицију током велике економске кризе, а у Русији је након слома комунизма била забрањена продаја алкохолних пића до 18ч.
Историја
уредиПрви пут чисти етанол је добио персијски лекар, научник, филозоф и писац Ебу Бекр Мухамед Ибн Зекерија ал-Рази путем дестилације вина. Назвао га је al-kuhl. Указао је на стерилизирајуће и дезинфекцијске особине алкохола и употребљавао га у медицинске сврхе.
У арапском језику الكحل [al-kuhul] се дословно користио као назив за шминку (за очи) и прах (антимона), а користио се као растварач. Касније је овај назив дошао у Европу преко Шпаније током арапског освајања. У шпанском језику реч alcohol (арап. الكحول [al-kahla]) се првобитно користила за фини, сухи прах, који су употребљавали алхемичари.
Референце
уреди- ^ „Ethanol – Compound Summary”. The PubChem Project. USA: National Center for Biotechnology Information.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). Boca Raton, FL: CRC Press. стр. 3.246. ISBN 1439855110.
- ^ Ballinger, P.; Long, F. A. (1960). „Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds1,2”. Journal of the American Chemical Society. 82 (4): 795—798. doi:10.1021/ja01489a008.
- ^ Arnett, E. M.; Venkatasubramaniam, K. G. (1983). „Thermochemical acidities in three superbase systems”. J. Org. Chem. 48 (10): 1569—1578. doi:10.1021/jo00158a001.
- ^ Lide, David R., ур. (2012). CRC Handbook of Chemistry and Physics (92 изд.). Boca Raton, FL.: CRC Press/Taylor and Francis. стр. 6—232.
- ^ Lide, David R., ур. (2008). CRC Handbook of Chemistry and Physics (89 изд.). Boca Raton: CRC Press. стр. 9-55.
- ^ Stogner, John M.; Eassey, John M.; Baldwin, Julie Marie; Miller, Bryan Lee (2014). „Innovative alcohol use: Assessing the prevalence of alcohol without liquid and other non-oral routes of alcohol administration”. Drug and Alcohol Dependence. 142: 74—78. PMID 25012895. doi:10.1016/j.drugalcdep.2014.05.026.
- ^ Gilman, Jodi M.; Ramchandani, Vijay A.; Crouss, Tess; Hommer, Daniel W. (28. 9. 2011). „Subjective and Neural Responses to Intravenous Alcohol in Young Adults with Light and Heavy Drinking Patterns”. Neuropsychopharmacology. 37 (2): 2011206. PMID 21956438. doi:10.1038/n.
- ^ Swift, Robert (2003). „Direct measurement of alcohol and its metabolites”. Addiction. 98: 73—80. PMID 14984244. doi:10.1046/j.1359-6357.2003.00605.x.
- ^ а б Becker, CE (12. 8. 2013). „The Clinical Pharmacology of Alcohol”. California Medicine. 113 (3): 37—45. PMC 1501558 . PMID 5457514.
- ^ Schmidt, Alexander (1974), Memorandum of Understanding Between The Bureau of Alcohol, Tobacco and Firearms and The Food and Drug Administration regarding the Promulgation and Enforcement of the Labeling Regulations Promulgated under the Federal Alcohol Administration Act, Washington, D.C.: Food and Drug Administration, Приступљено 24. 6. 2015
- ^ „Alcohol”. Drugs.com. Приступљено 7. 7. 2015.
- ^ Vengeliene, V.; Bilbao, A; Molander, A; Spanagel, R (2008). „Neuropharmacology of alcohol addiction”. British Journal of Pharmacology. 154 (2): 299—315. PMC 2442440 . PMID 18311194. doi:10.1038/bjp.2008.30. „(Compulsive alcohol use) occurs only in a limited proportion of about 10–15% of alcohol users....”
- ^ WHO Expert Committee on Problems Related to Alcohol Consumption : second report. (PDF). Geneva, Switzerland: World Health Organization. 2007. стр. 23. ISBN 9789241209441. Приступљено 3. 3. 2015. „.alcohol dependence (is) a substantial risk of regular heavy drinking...”
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ „10th Special Report to the U.S. Congress on Alcohol and Health: Highlights from Current Research” (PDF). National Institute of Health. National Institute on Alcohol Abuse and Alcoholism. 2000. стр. 134. Архивирано из оригинала (PDF) 21. 02. 2016. г. Приступљено 21. 10. 2014. „The brain is a major target for the actions of alcohol, and heavy alcohol consumption has long been associated with brain damage. Studies clearly indicate that alcohol is neurotoxic, with direct effects on nerve cells. Chronic alcohol abusers are at additional risk for brain injury from related causes, such as poor nutrition, liver disease, and head trauma.”
- ^ Brust, J. C. M. (2010). „Ethanol and Cognition: Indirect Effects, Neurotoxicity and Neuroprotection: A Review”. International Journal of Environmental Research and Public Health. 7 (4): 1540—57. PMC 2872345 . PMID 20617045. doi:10.3390/ijerph7041540.
- ^ McDonnell G, Russell AD; Russell (1999). „Antiseptics and disinfectants: activity, action, and resistance”. Clin. Microbiol. Rev. 12 (1): 147—79. PMC 88911 . PMID 9880479.
- ^ Calesnick, B.; Vernick, H. (1971). „Antitussive activity of ethanol”. Q J Stud Alcohol. 32 (2): 434—441. PMID 4932255.
- ^ „Methanol poisoning”. MedlinePlus. National Institute of Health. 30. 1. 2013. Приступљено 6. 4. 2015.
- ^ Appendix B, Transportation Energy Data Book from the Center for Transportation Analysis of the Oak Ridge National Laboratory
- ^ Reel, M. (August 19, 2006) "Brazil's Road to Energy Independence", The Washington Post.
- ^ Green, Ray. „Model T Ford Club Australia (Inc.)”. Архивирано из оригинала 14. 1. 2014. г. Приступљено 24. 6. 2011.
- ^ а б Thomas, George: Overview of Storage Development DOE Hydrogen Program. Livermore, CA. Sandia National Laboratories. 2000.
Литература
уреди- WHO Expert Committee on Problems Related to Alcohol Consumption : second report. (PDF). Geneva, Switzerland: World Health Organization. 2007. стр. 23. ISBN 9789241209441. Приступљено 3. 3. 2015. „.alcohol dependence (is) a substantial risk of regular heavy drinking...”
- Onuki, Shinnosuke; Koziel, Jacek A.; van Leeuwen, Johannes; Jenks, William S.; Grewell, David; Cai, Lingshuang (2008). Ethanol production, purification, and analysis techniques: a review. 2008 ASABE Annual International Meeting. Providence, RI. Приступљено 16. 2. 2013.
- Smith, M.G., and M. Snyder. (2005). "Ethanol-induced virulence of Acinetobacter baumannii". American Society for Microbiology meeting. Volume 1 June 5 – June 9. Atlanta.
- The National Institute on Alcohol Abuse and Alcoholism maintains a database of alcohol-related health effects. ETOH Archival Database (1972–2003) Alcohol and Alcohol Problems Science Database.
- Boyce, John M., and Pittet Didier. (2003). "Hand Hygiene in Healthcare Settings". Centers for Disease Control, Atlanta, Georgia, United States.
- Sci-toys website explanation of US denatured alcohol designations
- Norman L. Allinger, Michael P. Cava, Don C. de Jongh, Carl R. Johnson, Norman A. Lebel, Calvin L. Stevens: Organische Chemie. 1. izdanje, Walter de Gruyter. . Berlin. 1980. стр. 125—127. ISBN 978-3-11-004594-9. Недостаје или је празан параметар
|title=(помоћ). - Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 19. izdanje, S. Hirzel Verlag, Stuttgart. 1981. ISBN 978-3-7776-0356-8. стр. 115-117..
- Robert T. Morrison, Robert N. Boyd: Lehrbuch der Organischen Chemie. 3. izdanje, VCH, Weinheim. 1986. ISBN 978-3-527-26067-6. стр. 526-527..
- Beilstein: Handbuch der Organischen Chemie. 1. Band. стр. 292–314 (ext. Link).
Спољашње везе
уреди- Alcohol (Ethanol) at The Periodic Table of Videos (University of Nottingham)
- International Labour Organization ethanol safety information
- National Pollutant Inventory – Ethanol Fact Sheet
- CDC – NIOSH Pocket Guide to Chemical Hazards – Ethyl Alcohol
- National Institute of Standards and Technology chemical data on ethanol
- ChEBI – biology related
- Chicago Board of Trade news and market data on ethanol futures
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of ethanol
- Ethanol History A look into the history of ethanol
- ChemSub Online: Ethyl alcohol
- Industrial ethanol production process flow diagram using ethylene and sulphuric acid