Рецептори спрегнути с Г протеином
Рецептори спрегнути с Г протеином (GPCR), такође познати као седам-трансмембрански домен рецептори, 7ТМ рецептори, хептахеликсни рецептори, серпентински рецептори, и Г протеин-везани рецептори (GPLR), сачињавају велику протеинску фамилију трансмембранских рецептора који реагују на молекуле изван ћелије и активирају унутрашње путеве преноса сигнала. Крајњи резултат је ћелијски одговор. Рецептори спрегнути с Г протеином су присутни само код еукариота, што обухвата квасац, хоанофлагелате[2], и животиње. Лиганди који се везују и активирају ове рецепторе су: на фотосензитивна једињења, мириси, феромони, хормони, и неуротрансмитери. Они варирају по величини од малих молекула до пептида, и до великих протеина. Рецептори спрегнути с Г протеином имају учешћа у многим болестима и стога су биолошка мета за преко 30% свих савремених лекова.[3][4] Нобелова награда за хемију је 2012. додељења Брајану Кобилки и Роберту Лефковицу за њихов рад који је био „пресудан за разумевање начина на који рецептори спрегнути с Г протеином функционишу“.[5]
| ГПЦР | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификатори | |||||||||
| Симбол | 7тм_1 | ||||||||
| Пфам | ПФ00001 | ||||||||
| ИнтерПро | ИПР000276 | ||||||||
| ПРОСИТЕ | ПДОЦ00210 | ||||||||
| |||||||||

Постоје два основна начина преноса сигнала посредством рецептора спрегнутих с Г протеином: cAMP сигнални пут и фосфатидилинозитолни сигнални пут.[6] Кад се лиганд веже за GPCR, он изазива конформациону промену рецептора, што омогућава рецептору да делује као фактор размене гуанин нуклеотида (GEF). Након везивања лиганда, GPCR може да активира везани Г-протеин путем замене за њега везаног GDP-а са GTP-ом. Г протеинска α подјединица, заједно са везаним GTP-ом, се тада може дисоцирати од β и γ подјединица и формирати интеракције са интраћелијским сигналним протеинима, или директно са циљним функционалним протеинима, зависно од типа α подјединице (Gαs, Gαi/o, Gαq/11, Gα12/13).[7]:1160
Класификација уреди
Прецизна величина GPCR суперфамилије је непозната. Око 800 различитих људских гена (или ≈4% целокупног протеин-кодирајућег генома) је било предвиђено из геномске анализе секвенце. Мада су бројне класификационе шеме биле предложене, ова суперфамилија се класично дели у три главне класе (А, Б и C). Између ових класа нема значајне аминокиселинске хомологије. Далеко највећа међу њима је класа А, која сачињава скоро 85% GPCR гена. Од рецептора класе А, преко половине је предвиђено да кодира олфакторне рецепторе, док су лиганди преосталих рецептора позната ендогена једињења, или су класификовани као орфан рецептори. Упркос одсуства аминокиселинске хомологије између класа, сви GPCR рецептори имају заједничку структуру и механизам преноса сигнала.
GPCR рецептори се могу груписати у шест класа на основу аминокиселинске хомологије и функционалне сличности:[10][11][12][13]
- Класа А (или 1) (Родопсину-слични)
- Класа Б (или 2) (Секретинска рецепторска фамилија)
- Класа C (или 3) (Метаботропни глутамат/феромон)
- Класа D (или 4) (Гљивични феромонски рецептори)
- Класа Е (или 5) (Циклични АМП рецептори)
- Класа Ф (или 6) (Увојити/Заглађени)
Велика родопсин А група је подељена у 19 подгрупа (А1-А19).[14] Накнадно је један алтернативни класификациони систем под именом GRAFS (Глутамат, Родопсин, Адхезија, Увојити/Укус, Секретин) био предложен.[15]
Људски геном кодира скоро хиљаду Г протеин-спрегнутих рецептора,[16] око 350 од којих детектује хормоне, факторе раста, и друге ендогене лиганде. Приближно 150 GPCR рецептора људског генома нема познату функцију.
Постоји више биоинформатичких метода за предвиђање[17][18] GPCR функције, као и за њихову класификацију на основу аминокиселинске секвенце. Неки од њих користе приступ псеудо аминокиселинске композиције.[19]
Физиолошке улоге уреди
GPCR рецептори учествују у широком варијетету физиолошких процеса. Примери тих физиолошких улога су:
- чуло вида: опсини користе реакцију фотоизомеризације за транслацију електромагнетске радијације у ћелијске сигнале. Родопсин, на пример, користи конверзију 11-цис-ретинала у све-транс-ретинал за ту сврху
- чуло мириса: рецептори мирисног епитела (мирисни рецептори) везују одоранте и феромоне (вомероназални рецептори)
- регулација понашања и расположења: рецептори у мозгу сисара везују више различитих неуротрансмитера, као што су серотонин, допамин, GABA и глутамат
- регулација активности имунског система и инфламације: хемокински рецептори везују лиганде који посредују интерцелуларну комуникацију између ћелија имунског система; рецептори попут хистаминског рецептора везују инфламаторне посреднике и дејствују на циљне ћелијске типове инфламаторног одговора
- пренос сигнала аутономног нервног система: симпатички и парасимпатички нервни системи су регулисани ГПЦР путевима, одговорним за контролу многих аутоматских функција тела као што су крвни притисак, срчани пулс и процеси варења
- индикација ћелијске густине: нова GPCR улога у регулацији ћелијске густине.
Структура рецептора уреди
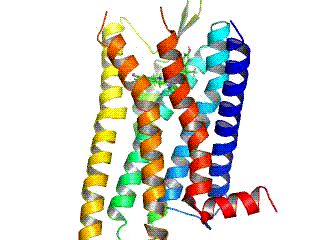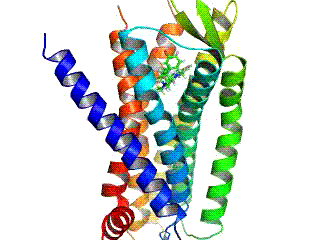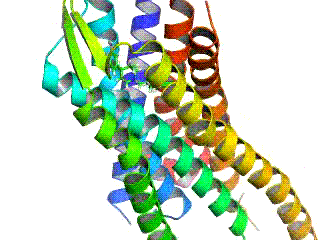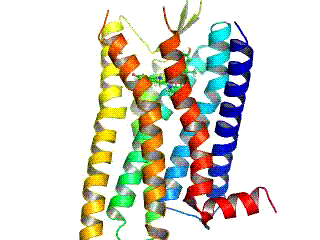
GPCR рецептори су интегрални мембрански протеини који поседују седам транс-мембранских домена, или трансмембранских хеликса. Екстрацелуларни делови рецептора могу бити гликозилирани. Те екстрацелуларне петље такође садрже два висококонзервирана цистеинска остатка који формирају дисулфидни мост којом се стабилизује рецепторска структура. Неки од седам-трансмембранских хеликсних протеина (канални родопсин), који подсећају на GPCR рецепторе, могу да садрже јонске канале, унутар својих протеина.
Рани структурни модели GPCR рецептора су били базирани на њиховој слабој аналогији са бактериородопсином, чија структура је била утврђена путем електронске дифракције (2БРД, 1АТ9)[20][21] и Рендгенске структурне анализе (1АП9).[22] 2000. године, прва кристална структура GPCR рецептора сисара, говеђег родопсина (1Ф88), је била решена.[23] Док су главне особине, седам трансмембранских хеликса, очуване, релативна оријентација хеликса је знатно различита од бактериородопсина. 2007. године је прва структура људског GPCR рецептора била решена: (2Р4Р, 2Р4С).[24] Томе је убрзо следила структура високе резолуције истог рецептора (2РХ1).[25][26] За људску GPCR структуру β2-адренергичког рецептора, се испоставило да је веома слична говеђем родопсину у погледу релативне оријентације седам-трансмембранских хеликса. Међутим конформација друге екстрацелуларне петље је потпуно различита код ове две структуре. Пошто та петља сачињава „поклопац“ који покрива врх лиганд везујућег места, ова конформациона разлика је добра илустрација потешкоћа у конструисању хомологних модела других GPCR рецептора на основу структуре родопсина.
Структурно-функциони односи уреди
Структура GPCR рецептора садржи карактеристични екстрацелуларни N-терминус, чему следи седам трансмембранских (7-ТМ) α-хеликса (ТМ-1 до ТМ-7) повезаних са три интрацелуларне (IL-1 до IL-3) и три екстрацелуларне петље (EL-1 то EL-3), и коначно интрацелуларни C-терминус. GPCR формира терцијарну структуру која подсећа на буре. Седам трансмембранских хеликса формира шупљину унутар ћелијске мембране која служи као лиганд-везујући домен, који је често прекривен са EL-2. Лиганди такође могу да се вежу на другим местима, као што је случај са гломазнијим лигандима (нпр., протеинима, или великим пептидима) који интерагују са екстрацелуларним петљама, или, као што је то илустровано код класе C метаботропних глутаматних рецептора (mGluR), са N-терминалним доменом. GPCR рецептори класе C се имају позамашан N-терминални реп са добро дефинисаном терцијарном структуром. Он садржи лиганд-везујући домен. Након везивања глутамата за mGluR рецептор, N-терминални реп подлеже конформационој промени која доводи до његове интеракције са остацима екстрацелуларних петљи и ТМ доменом. Крајњи ефекат свих типова агонист-индуковане активације је промена релативне оријентације ТМ хеликса (праћена увијајућим кретањем) То доводи до повећања интрацелуларне површине и отварања приступа додатним аминокиселинским остацима ТМ домена који су критични за функцију преноса сигнала (нпр. за интеракцију са Г-протеом). Инверзни агонисти и антагонисти се могу везати на истом и неколико других места. Њихов ефекат је спречавање стабилизације ТМ хеликсне оријентације која је подесна за пренос сигнала.
Структура N- и C-краја GPCR рецептора може имати друге важне функције, поред везивања лиганда. Специфично, C-терминус често садржи серин (Ser) или треонин (Thr) остатке који након фосфорилације, повећавају афинитет интрацелуларне површине за везивање скелеталних протеина, познатих под именом β-арестини (β-arr). Једном везани, β-арестини стерно спречавају формирање Г-протеин спреге, и могу да регрутују друге протеине што доводи до стварања сигналних комплекса који учествују у активацији ERK сигналног пута, или рецепторске ендоцитозе (интернализације). Пошто се фосфорилација тих Ser и Thr остатака често јавља услед GPCR активације, β-arr-посредовано Г-протеин-раздвајање и интернализација GPCR рецептора су важни механизми десензитизације.[27]
Још један заједнички структурни мотив GPCR рецептора је палмитоилација једног или више места C-терминала или интрацелуларних петљи. Палмитоилација је ковалентна модификација цистеинских (Cys) остатака путем адиције хидрофобних ацил група. Она има ефекат усмеравања рецептора ка холестеролом и сфинголипидом богатим микродоменима мембране плазме који се називају липидни сплавови. Како су многи низводни трансдукторски и ефекторски молекули GPCR рецептора (у шта се уврштавају и они који учествују у негативним повратним сигналним путевима) такође усмерени ка липидним сплавовима, нето ефекат палмитоилације је веома брза рецепторска сигнализација.
GPCR рецептори одговарају на екстрацелуларне сигнале који су посредовани великим бројем различитих агониста, од протеина до биогених амина до протона. Сви они преносе сигнал механизмом Г-протеинске спреге. То је омогућено присуством фактора размене гуанин-нуклеотида (GEF), који је домен формиран комбинацијом интрацелуларних петљи ИЛ-2, ИЛ-3 и оближњих аминокиселинских остатака ТМ хеликса.
Механизам уреди
Г протеин-спрегнути рецептор се активира спољашњим сигналом у облику лиганда или неког другог сигналног медијатора. То узрокује конформациону промену рецептора, те долази до активације Г протеина. Даљи ефекат зависи од типа Г протеина.
Везивање лиганда уреди
GPCR рецептори обухватају рецепторе за сензорне сигналне посреднике (нпр., светло и мирисни стимулаторни молекули); аденозин, бомбезин, брадикинин, ендотелин, γ-аминобутерна киселина (GABA), фактор раста хепатоцита (HGF), меланокортини, неуропептид Y, опиоид пептиди, опсини, соматостатин, тахикинини, чланови фамилије вазоактивних интестиналних пептида, и вазопресин; биогени амини (нпр., допамин, епинефрин, норепинефрин, хистамин, глутамат (метаботропни ефекат), глукагон, ацетилхолин (мускарински ефекат), и серотонин); хемокини; липидни медијатори инфламације (нпр., простагландини, простаноиди, тромбоцит-активирајући фактор, и леукотриени); и пептидни хормони (нпр., калцитонин, C5a анафилатоксин, фоликул-стимулишући хормоне (FSH), гонадотропин-ослобађајући хормоне (GnRH), неурокинин, тиреотропин-ослобађајући хормоне (TRH), и окситоцин). GPCR рецептори реагују на стимулансе који још нису били идентификовани су познати као орфан рецептори.
Док се код других рецепторских типова лиганди углавном везују са спољашње стране мембране, GPCR лиганди се већином везују унутар трансмембранског домена. Специјалан случај су протеазом-активирани рецептори, које активира одсецање дела њиховог екстрацелуларног домена.[29]
Конформациона промена уреди
Трансдукција сигнала рецептором кроз мембрану није потпуно разјашњена. Познато је да је неактивни Г протеин везан за рецептор у његовом неактивном стању. Након везивања лиганда, рецептор промени конформацију и тако механички активира Г протеин, који се одваја од рецептора. Рецептор може затим било да активира још један Г протеин, или да се врати у своје неактивно стање. Мада је ово објашњење сувише поједностављено, оно је довољно да одслика свеукупни сет акција.
Сматра се да је молекул рецептора у конформационом еквилибријуму између активних и неактивних биофизичких стања.[30] Везивање лиганда за рецептор може да помери еквилибријум ка активном стању рецептора.[31] Постоје три типа лиганда: Агонисти су лиганди који померају еквилибријум у корист активних стања; инверзни агонисти су лиганди који померају еквилибријум у корист неактивних стања; и неутрални антагонисти су лиганди који не утичу на еквилибријум. Још увек није познато како се егзактно активна и неактивна стања међусобно разликују.
Г-протеински циклус активације/деактивације уреди
Кад је рецептор неактиван, ГЕФ домен може бити везан за једну исто тако неактивну α-подјединицу хетеротримерног Г-протеина. Г-протеини су тримери α, β и γ подјединица (познатих као Gα, Gβ и Gγ, респективно) које су неактивне кад су реверзибилно везане за Гуанозин-дифосфат (GDP) (или алтернативно, без гуанин нуклеотида). Оне су активне када су везане за Гуанозин-трифосфат (GTP). Након активације рецептора, GEF домен алостерно активира Г-протеин путем размене молекула GDP за GTP на Г-протеин α-подјединици. Ћелије одржавају 10:1 однос цитосолног GTP:GDP тако да је размена за GTP осигурана. Субсеквентно се подјединице Г-протеина дисоцирају од рецептора као и међусобно да би произвеле Gα-GTP мономер и чврсто интерагујући Gβγ димер, који су сад слободни да модулирају активност других интрацелуларних протеина. До ког ступња може да дође до њихове дифузије, међутим, је ограничено Gα палмитоилацијом и присуством гликозил-фосфатидилинозитол (GPI) молекула ковалентно додатих на Gγ C-терминус. Фосфатидилинозитолни део GPI молекула садржи две хидрофобне ацил групе које учвршћују GPI-везане протеине (нпр. Gβγ) за мембрану плазме, и исто тако у одређеној мери, за локални липидни сплав. (Упоредите ово са ефектом палмитоилације на ГПЦР локализацију дискутовану изнад)
Зато што Gα такође има способност споре GTP→GDP хидролизе, неактивна форма α-подјединице (Gα-GDP) се временом регенерише, чиме се омогућава реасоцијација са Gβγ димером и формирање “одмарајућег” Г-протеина, који може поново да се веже за GPCR и чека на активацију. Брзина GTP хидролизе је често повишена акцијама једне друге фамилије алостерно модулисаних протеина званих регулатори Г-протеин сигнализације, или RGS протеини. Они су тип активирајућег протеина GTPазе, или GAP. Познато је да многи од примарних ефекторских протеина (нпр. аденилат циклазе), који постају активирани/деактивирани након интеракције са Gα-GTP, такође имају GAP активност. На тај начин, чак и у овом раном ступњу процеса, GPCR-иницирана сигнализација има способност само-окончања.
GPCR сигнализација уреди
Ако рецептор у активном стању дође у контакт са Г протеином, он може да га активира. Постоји евиденција да су рецептори и Г протеини заправо пре-спрегнути. На пример, везивање Г протеина за рецепторе има утицаја на афинитет рецептора за лиганде. Активирани Г протеини су везани за GTP.
Даљи пренос сигнала је завистан од типа Г протеина. Ензим аденилат циклаза је пример целуларног протеина који може бити регулисан Г протеином, у овом случају Г протеином Gs. Аденилат циклаза је активирана кад се веже за подјединицу активираног Г протеина. Активација аденилат циклазе се окончава кад се Г протеин врати у GDP-везано стање.
Аденилат циклазе, од којих је код људи познато 9 форми везаних за мембрану и једна цитосолна форма, могу такође бити активиране или инхибиране на друге начине, на пример путем везивања Ca2+/калмодулина. Ово може променити активност тих ензима на адитиван или синергистички начин упоредо са Г протеинима.
GPCR активирани сигнални путеви су ограничени примарном секвенцом и терцијарном структуром GPCR рецептора. Оне су ултиматно одређене специфичном конформацијом стабилизованом датим лигандом, као и доступношћу трансдукторских молекула. Сматра се да GPCR рецептори користе два примарна типа трансдуктора: Г-протеине и β-арестине. Пошто β-арестини имају висок афинитет за фосфорилисану форму већине GPCR рецептора, највећи део преноса сигнала је ултиматно завистан од Г-протеинске активације. Међутим, не долази до Г-протеин независног преноса сигнала, јер увек постоји могућност остваривања оба типа интеракција.
Г протеин зависна сигнализација уреди
Постоје три главна Г протеином посредована сигнална пута. Они су зависни од четири поткласе Г-протеина које се међусобно разликују по хомологији секвенце (Gαs, Gαi/o, Gαq/11, и Gα12/13). Свака поткласа Г-протеина се састоји од више протеина, сваки од којих је продукт више гена и/или сплајсних варијација што може да произведе разлике које се крећу од суптилних до очигледних у погледу сигналних особина, мада су генерално доста добро груписане у оквиру четири класе. Зато што су особине преноса сигнала разних могућих βγ комбинација међусобно сличне, те класе су дефинисане на основу изоформе њихове α-подјединице.[32]
Док већина GPCR рецептора може да активира више од једног Gα-подтипа, они имају преференцију за један од подтипова. Кад је активирани подтип завистан од лиганда везаног за GPCR, то се назива функционална селективност (која је такође позната као агонист-усмерено размена, или конформационо специфични агонизам). Међутим, везивање било ког појединачног агониста може такође да иницира активацију више различитих Г-протеина, уколико он има способност стабилизовања више конформација GPCR GEF домена, чак и у току једне интеракције. Додатно, конформација која преференцијално активира једну Gα изоформу може да активира неку другу изоформу, ако је преферирани протеин мање доступан. Поред тога, путеви повратне спреге могу да резултују у посттранслационим модификацијама рецептора (нпр. фосфорилацијама), које мењају Г-протеин преференције. Поред свих тих нијанси, уобичајени GPCR партер је обично дефинисан на основу Г-протеина који је најочевидније активиран ендогеним лигандом под физиолошким и/или експерименталним условима.
Gα сигнализација уреди
- Ефектор Gαs и Gαi/o путева је циклични аденозин монофосфат (cAMP) генеришући ензим аденилат циклаза, или AC. Постоји десет различитих AC генских продуката код сисара, сваки од којих је суптилно специфичан у погледу ткивне дистрибуције и/или функције. Сви они катализују конверзију цитосолног аденозин трифосфата (ATP) у cAMP, и сви су директно стимулисани Г-протеинима Gαs класе. У контрасту с тим, интеракција са Gα подјединицама Gαi/o типа инхибира AC cAMP генерисање. На тај начин, GPCR рецептори спрегнути са Gαs неутралишу акције рецептора спрегнутих са Gαi/o, и вице верса. Ниво цитозолног cAMP може да услови активност разних јонских канала, као и чланова фамилије Ser/Thr- специфичних протеинска киназа А (PKA). Ис тих разлога cAMP се сматра секундарним гласником, и PKA секундарним ефектором.
- Ефектор Gαq/11 пута фосфолипаза C-β (PLCβ), која катализује расцеп за мембрану везаног фосфатидилинозитол 4,5-бифосфата (PIP2) у секундарне гласнике инозитол (1,4,5) трифосфат (IP3) и диацилглицерол (DAG). IP3 делује на IP3 рецепторе који су лоцирани на мембрани ендоплазматичног ретикулума (ER) и побуђује ослобађање Ca2+ из ER, док DAG дифузује дуж мембране плазме где може да активира било коју форму секундарне Ser/Thr киназе локализоване на мембрани, такозване протеинске киназе C (PKC). Пошто су многе PKC изоформе такође активиране повишеним нивоима интрацелуларног Ca2+, ова два пута могу међусобно да конвергирају и пренесу сигнал истим секундарним ефектором. Повишени интрацелуларни Ca2+ се исто тако везује и алостерно активира калмодулин протеине, који након тога везују и алостерно активирају ензиме као што су Ca2+/калмодулин-зависне киназе (CAMK).
- Ефектори Gα12/13 пута су три RoGEF протеина (p115-RoGEF, PDZ-RoGEF, и LARG), који кад су везани за Gα12/13 алостерно активирају цитосолну малу GTPazu, Ro. Једном везана за GTP, Ro може да активира разне протеине одговорне за регулацију цитоскелетона, као што је Ro-киназе (ROCK). Већина GPCR рецептора који се спрежу са Gα12/13 такође могу да формирају спреге са другим поткласама, често са Gαq/11.
Gβγ сигнализација уреди
Горе дати опис не узима у обзир ефекте Gβγ–сигнализације, који су такође значајни, посебно у случају активираног Gαi/o-спрегнутог GPCR рецептора. Примарни Gβγ ефектори су разни јонски канали, као што су Г-протеин-спрегнути унутрашње-исправљајући K+ канали (GIRK), P/Q-, и N-тип од напона зависни Ca2+ канали, као и неке AC и PLC изоформе, заједно са појединим изоформама фосфоинозитид-3-киназе (PI3K).
Г протеин независна сигнализација уреди
Мада се за Г рецепторе мисли да они могу само да делују заједно са Г протеинима, GPCR рецептори могу да преносе сигнал механизмима независним од Г-протеина. Хетеротримерни Г протеини исто тако имају функционалне улоге које су независне од GPCR рецептора. GPCR рецептори могу да самостално преносе сигнал посредством више типова протеина, као што су β-арестин, GRK, и Src. Осим тога, додатни скелетални протеини који учествују у GPCR субцелуларној локализацији (нпр. PDZ-домен садржавајући протеини) могу такође да делују као преносници сигнала. Ефектори су најчешће чланови MAPK фамилије.
Примери уреди
Касних 1990-тих година, докази су почели да се акумулирају да неки GPCR рецептори имају способност преноса сигнала без Г протеина. За ERK2 митогеном активиране протеинске киназе, које су кључни медијатори преноса сигнала низводно од рецепторске активације у многим путевима, је било показано да се активирају у одговору на cAMP посредовану активацију рецептора код буђи из муља (D. discoideum), упркос одсуства спрегнутих Г протеинских α- и β-подјединица.[33]
У ћелијама сисара, за екстензивно проучавани β2-адрено рецептор је демонстрирано да активира ERK2 пут након арестином посредованог раскида спреге Г-протеином посредоване сигнализације. Из овог следи да су неки од механизама за које се раније веровало да су искључиво везани за десензитизацију рецептора, заправо примери промене рецепторских путева, а не једноставно њиховог искључивања.
У ћелијама бубрега, за брадикинин рецептор B2 је показано да интерагује директно са протеинском тирозинском фосфатазом. Присуство тирозин-фосфорилисане ITIM (имунорецептор тирозин-базираног инхибиторног мотива) секвенце у B2 рецептору је неопходно за његово посредовање те интеракције и накнадно антипролиферативно дејство брадикинина.[34]
GPCR-независна сигнализација путем хетеротримерних Г-протеина уреди
Мада је то релативно неразвијена област, постоје индикације да хетеротримерни Г-протеини могу да учествују у GPCR-независном преносу сигнала. Постоји евиденција о њиховој улози преносиоца сигнала код скоро свих других типова рецепторски посредоване сигнализације, попут интегрина, рецепторских тирозинских киназа (RTK), цитокинских рецептора (JAK/STAT), као и за модулацију разних других „помоћних“ протеина као што су GEF, инхибитори дисоцијације гуанозин нуклеотида (GDI) и протеинске фосфатазе. Могуће је да постоје специфични протеини из ове класе чија примарна функција је у оквиру GPCR-независних путева.
cAMP и PIP2 путеви уреди
Постоје два главна начина преноса сигнала у којима учествују рецептори спрегнути с Г протеином: cAMP сигнални пут и фосфатидилинозитолни сигнални пут.[6]
cAMP сигнални пут уреди
cAMP сигнални пренос се састоји од пет главних компоненти:
- стимулативни хормонски рецептор (Rs), или инхибиторни хормонски рецептор (Ri)
- стимулативни регулишући Г протеин (Gs), или инхибиторни регулаторни Г протеин (Gi)
- Аденилил циклаза
- Протеинска киназа А (PKA)
- cAMP фосфодиестераза.
Стимулативни хормонски рецептор (Rs) везује стимулативне сигналне молекуле, док инхибиторни хормонски рецептор (Ri) везује инхибиторне сигналне молекуле.
Стимулативни регулишући Г протеин формира интеракције са стимулативним хормонским рецептором, и његове подјединице након активације могу да стимулишу активност ензима, или други интраћелијски метаболизам. Насупрот томе, инхибиторни регулаторни Г протеин се спреже са инхибиторним хормонским рецептором и његова α подјединица након активације може да инхибира активност ензима или други интраћелијски метаболизам.
Аденилил циклаза је глукопротеин са 12 трансмембранских хеликса. Она катализује прелаз ATP-а у cAMP уз помоћ кофактора Mg2+ или Mn2+. Настали cAMP је секундарни гласник у ћелијском метаболизму и алостерни активатор протеинске киназе А.
Протеинска киназа А је важан ензим у ћелијском метаболизму. Она има способност да регулише ћелијски метаболизам путем фосфорилације специфичних наменских ензима у метаболичком путу. Она такође може да регулише изражавање специфичних гена, ћелијску секрецију, и мембранску пермеабилност. Овај ензим садржи две каталитичке подјединице и две регулаторне подјединице. Овај комплекс је неактиван у одсуству cAMP-а. Кад се cAMP веже за регулаторне подјединице, мења се њихова конформација и долази до дисоцијације регулаторних подјединица, чиме се активира протеинска киназа А и омогућавају даљи биолошки ефекти.
cAMP фосфодиестераза је ензим који може да разгради cAMP до 5'-АМП-а, чиме се окончава сигнал.
Фосфатидилинозитолни сигнални пут уреди
У сигналном путу фосфатидилинозитола, екстрацелуларни сигнални молекул се везује за рецептор спрегнут с Г протеином (Gq) на ћелијској површини и активира фосфолипазу C, која је лоцирана на ћелијској мембрани. Липаза хидролизује фосфатидилинозитол 4,5-бисфосфат (PIP2) у два секундарна гласника: инозитол 1,4,5-трисфосфат (IP3) и диацилглицерол (DAG). IP3 се везује за рецептор у мембрани глатког ендоплазматичног ретикулума и митохондрија, чиме помаже отварање Ca2+ канала. DAG помаже активацију протеинске киназе C (PKC), која фосфорилизује многе друге протеине, мењајући тиме њихове каталитичке активности, што доводи до ћелијског одговора. Дејство Ca2+ јона је исто тако важно. Они заједно са DAG-ом активирају PKC и могу да доведу до активације CaM киназног пута, у коме калцијум модулисани протеин калмодулин (CaM) везује Ca2+, подлеже промени конформације, и активира CaM киназу II. Она има јединствену способност повећања свог афинитета везивања за CaM путем аутофосфорилације, што чини CaM недоступним за активацију других ензима. Киназа затим фосфорилизује циљне ензиме, чиме регулише њихове активности. Ова два сигнална пута повезује Ca2+-CaM, који је такође регулаторна подјединица аденилил циклазе и фосфодиестеразе у cAMP сигналном путу.
Регулација рецептора уреди
Рецептори спрегнути с Г протеином подложни су десензитизацији кад су изложени њиховом лиганду током дужег временског периода. Познате су две форме десензитизације:
- хомологна десензитизација, при којој је активирани ГПЦР производи умањени одговор, и
- хетерологна десензитизација, где активирани ГПЦР узрокује умањење одговора других рецептора.
Кључна реакција овог процеса је фосфорилација интрацелуларног (или цитосолног) рецепторског домена протеинским киназама.
Фосфорилација cAMP зависном протеинском киназом уреди
Протеинске киназе А (од цикличног АМП-а зависне протеинске киназе) се активирају сигналним ланцом који почиње од активираног Г протеина посредством аденилат циклазе и цикличног АМП-а (цАМП-а). У механизму повратне спреге, ове киназе након активације фосфорилишу рецептор. Што дуже рецептор остаје активан, то се више активирају киназе, и утолико више долази до фосфорилације рецептора. Код β2-адренорецептора, та фосфорилација резултује у промени спреге од Gs класе Г-протеина до Gi класе.[35] PKA посредована фосфорилација може да узрокује хетерологну десензитизацију рецептора.[36]
Фосфорилација посредством ГРК киназа уреди
Киназе рецептора спрегнутих с Г протеином (GRK) протеинске су киназе које фосфорилишу ГПЦР рецепторе.
Фосфорилација рецептора може да има две последице:
- Транслокација: Рецептор се, заједно са делом мембране у којој је смештен, уноси у унутрашњост ћелије, где се дефосфорилизује у киселом окружењу везикула[37] и затим се враћа у мембрану. Овај механизам се користи за регулацију дуготрајног излагања, на пример хормонима. Алтернативно, рецептор може да подлегне лизозомалној деградацији, или да остане интернализован, у ком случају се сматра да учествује у иницијацији сигнализације, природа које је зависна од локализације интернализоване везикуле.[36]
- Везивање арестина: Фосфорилисани рецептор се може везати за молекуле арестина чиме се спречава везање за Г протеине, те се ефективно искључује током неког временског периода. Том механизму се подвргава на пример родопсин у ћелијама ретине током компензације за излагање јаком светлу. У многим случајевима, везивање арестина за рецептор је предуслов за транслокализацију. На пример, бета-арестин везан за β2-адренорецепторе делује као адаптер везивања клатрина, и са бета-подјединицом АП2 (клатрин адаптерског молекула); тако да арестин овде делује као основа за монтажу компоненти потребних за клатрином посредовану ендоцитозу β2-адренорецептора.[38][39]
Механизми терминације ГПЦР сигнала уреди
Као што је горе напоменуто, Г-протеини могу да прекину сопствену активацију посредством њиховог унутрашњег GTP→GDP хидролизног дејства. Међутим, та реакција тече малом брзином (≈0,02 пута/секунди), тако да ако се изузму други фактори потребно је око 50 секунди да се један Г-протеин деактивира. Постоји око 30 изоформи RGS протеина, који кад су везани за Gα кроз њихов GAP домен, убрзавају хидролизу на око ≈30 пута/секунди. Ово повећање брзине од око 1500 пута омогућава ћелији да брзо одговори на спољашње сигнале, и производи просторну резолуцију услед ограничене количине секундарног гласника која се може генерисати, као и ограниченог растојања на које се Г-протеин може померити дифузијом током 0,03 секунде. RGS протеини су углавном неспецифични у њиховој способности да активирају Г протеине. Избор RGS протеина који учествује у датом сигналном путу је првенствено завистан од типа ткива и ГПЦР рецептора. РГС протеини имају додатну функцију повећања брзине GTP-GDP размене на ГПЦР рецепторима, другим речима они делују попут GEF-а, чиме додатно доприносе повећању резолуције ГПЦР сигнализације.
ГПЦР рецептори исто тако могу да произведу хомологну десензитизацију. До тога може доћи на следеће начине:
- директан резултат дејства лиганда, при чему промена конформације омогућава регрутовање ГРК киназа које фосфорилишу разне серинске/треонинске остатке на ИЛ-3 и C-терминусном репу. Након ГРК фосфорилације, афинитет ГПЦР рецептора за β-арестин (β-арестин-1/2 у већини ткива) се повећава. Везивање β-арестина може да стерно онемогући спрегу Г-протеина. Они исто таком могу да иницирају процес интернализације рецептора путем клатрином посредоване ендоцитозе. До десензитизације рецептора на овај начин може да дође само у присуству лиганда, те се она назива хомологном десензитизацијом[27]
- афинитет за β-арестин се може повећати независно од излагања лиганду и ГРК посредовања. До тога долази путем фосфорилације различитих Сер/Тхр места (такође на ИЛ-3 и C-терминусном репу) дејством PKC и PKA. Те фосфорилације су често довољне да омету формирање спреге са Г-протеинима.
- PKC/PKA могу да фосфорилују GRK киназе, што може да узрокује даљу фосфорилацију ГПЦР рецептора и везивање β арестина. Тај процес је независтан од концентрације лиганда. Ова два задња механизма омогућавају десензитизацију ГПЦР рецептора дејством других рецептора (хетерологна десензитизација). GRK кинизе исто тако могу да садрже GAP домене и да тим путем допринесу инактивацији, механизмом који је независтан од киназа. Јављају се и комбинација ових механизама.
Након везивања β-арестина за ГПЦР, он подлеже конформационој промени која му омогућава да служи као основни протеин за адаптерски комплекс под називом AP-2, који може да регрутује протеин клатрин. Ако довољан број рецептора у датој локалној области регрутује клатрин на овај начин, они формирају агрегате и мембрана се деформише ка унутрашњости ћелије као резултат интеракција између молекула клатрина у процесу опсонизације. Кад је удубљење једном формирано, ћелијска мембрана дејством два друга протеина звана амфифизин и динамин, формира ендоцитозну везикулу. Након тога се адаптерски молекули и клатрин дисоцирају, и рецептор се било враћа у протеинску мембрану, или се разлаже лизозомима.[40]
У било којој тачки овог процеса, β-арестини могу да регрутују друге протеине као што су нерецепторска тирозинска киназа (nRTK) и c-SRC, који могу да иницирају активацију ERK1/2, или других митогеном активираних протеинских киназа (МАПК). Оне преносе сигнал путем, на пример, фосфорилације малих ГТП-аза, Ras, или директног регрутовања протеина ЕРК каскаде (и.е., Raf-1, MEK, ERK-1/2) у ком случају се сигнализација иницира услед њихове просторне колокације. Још једна мета c-SRC киназе су динамин молекули који учествују у ендоцитози. Динамини се полимеризују око врата улазећих везикула, и њихова фосфорилација c-SRC киназом даје енергију која је неопходна за конформациону промену којом се остварује финално одвајање од мембране.
ГПЦР ћелијска регулација уреди
Десензитизација рецептора је посредована комбинацијом фосфорилације, везивања β-арестина, и ендоцитозе. До умањеног респонса долази кад се ендозом који садржи рецептор споји са лизозомом. Лизозомне мембране су богате у протонским пумпама те њихова унутрашњост има низак pH (≈4.8 вс. pH≈7.2 цитозола), што узрокује денатурацију ГПЦР рецептора. Додатно, лизозоми садрже многе деградативне ензиме, укључујући протеазе, које делују само на таквим ниским pH вредностима, тако да може да дође до разлагања пептидних веза ГПЦР рецептора. Низ фактора условљава да ли ће рецептор бити разложен или враћен у мембрану. Неки од њих су тип рецептора и магнитуда сигнала.
ГПЦР регулација је додатно посредована факторима транскрипције гена. Ти фактори могу да повећају или умање изражавање гена и тако услове формирање нових рецептора (тзв. повећана или умањена регулација).
Олигомерација рецептора уреди
Рецептори спрегнути с Г протеином могу да формирају хетеромере попут хомо- и хетеродимера као и комплексније олигомерне структуре. Директне рецептор-рецептор интеракције могу да формирају функционалне рецепторе од неактивних мономера. Показано је да је хетеродимеризација есенцијална за функционисање рецептора као што су метаботропни ГАБА(Б) рецептори. Улога олигомеризација није довољно разјашњена. Сматра се да тај феномен на известан начин доприноси фармаколошкој хетерогености ГПЦР рецептора. Ова тема се активно истражује.
Експериментално је показано да ГПЦР химере или скраћени фрагменти, који су индивидуално неактивни, попримају способност везивања и сигнализације ако су изражени у истој мембрани.[41][42] Ово запажање само по себи не идентификује улогу олигомеризације у ГПЦР функцији, међутим оно демонстрира да рецептор-рецептор интеракције могу да утичу на везивање агониста и интеракције са Г протеинима. Исто тако се може закључити да су међумолекулске интеракције једнако важне као и интрамолекулске интеракције које директно производе активацију рецептора.
Након објављивања ових налаза, знатан број студија о ГПЦР димеризацији је спроведен.[43][44][45][46][47][48][49][50][51][52] Упркос томе разумевање функционог значаја олигомеризације је и даље непотпуно, а у неким случајевима и контроверзно.[53] До овог закључка такође су дошли Терилон и Боувиер у недавном прегледу ГПЦР димеризације.[50]
Најбоље испитани примери олигомерације рецептора су метаботропни ГАБАБ рецептори. Ти рецептори се формирају хетеродимеризацијом ГАБАБР1 и ГАБАБР2 подјединица. Изражавање ГАБАБР1 без ГАБАБР2 у хетерологним системима доводи до задржавања те подјединице у ендоплазматичном ретикулуму. Изражавање само ГАБАБР2 подјединице, међутим, доводи до њеног изласка на површини ћелије, међутим она није функционална (и.е., рецептор не везује агонист, те не иницира одговор након излагања агонисту). Кад су обе подјединице заједно изражене функционални рецептори доспевају на ћелијску површину. Показано је да ГАБАБР2 везивање за ГАБАБР1 узрокује маскирање ретенционог сигнала[54] функционалних рецептора.[55][56][57][58]
У овом случају је утврђено да се структурни захтев налази у C-терминусу, где постоји секвенца склона формирању интеракција намотаног калема.[54] Ово је у контрасту с једним другим чланом фамилије ГПЦР рецептора, глутаматним рецептором типа 1, где до димеризације долази на Н-терминусу.[59] Његов велики домен „муволовке“ је структурно сличан са везујућим доменом глутаматних рецепторских канала, где они формирају стабилне олигомерне форме.[60] Мада су ови примери специјални случајеви, постоје докази да се ГПЦР рецептори димеризују да би деловали као молекулски пратиоци, најчешће да би катализовали своје сопствено савијање и транспорт до ћелијске површине. Докази су најдоступнији за фамилију А ГПЦР рецептора, нпр. В2 вазопресинске рецепторе[61][62] и хемокински рецептор CCR5.[52][63]
Улога димеризације у ГПЦР онтогенези не искључује могућност да кад једном рецептор досегне ћелијску површину, његово олигомерно стање не може да буде динамички регулисано лигандом. Експерименти базирани на FRET-u и биолуминесцентном енергетском трансферу (BRET) су показали да многи ГПЦР рецептори постоје као олигомери, или да су бар у блиско пакованим кластерима, у мембранама живих ћелија.[43][44][45][46][47][48][49][50] Међутим, они су маргинално допринели побољшању разумевања функционалне релевантности. Заправо, пошто већина тих студија показује да везивање агониста не производи знатну промену оптичког сигнала, може се закључити да су ГПЦР рецептори конститутивни димери и да се таква супрамолекуларна организација не осујећује стањем активације протеина. Из бројних ФРЕТ и БРЕТ мерења произлази да не долази ни до повећања удела, нити до разградње димериног стања, те да димери нису неопходни за рецептором посредовану активацију Г протеина. Алтернативна интерпретација је да нема евиденције којом би се доказало да димерни ГПЦР рецептори нису мандаторне структуре за остваривање продуктивне интеракције са Г протеинским хетеротримером. Структурни и биохемијски докази сугеришу да везивна површина Г протеинског тримера може да формира интеракцију са димерним ГПЦР рецептором,[64][65] мада се нека запажања могу интерпретирати као индикација да цитосолни регион мономерног ГПЦР рецептора подлеже знатним конформационим променама након интеракције са Г протеином.[66] Недавно су елегантни експерименти, који су се састојали од комбинације масене спектрометрије након хемијског повезивања и неутронског расипања у раствору, недвосмислено показали да је комплекс формиран између пречишћеног, активираног леукотриенског Б4 рецептора BLT1 и Giα2β1γ2 пентамерни склоп једног димерног рецептора и хетеротримерног Г протеина.[67]
Порекло и диверсификација суперфамилије уреди
Пренос сигнала посредован ГПЦР суперфамилијом датира из доба појаве првих облика мултицелуларности. Недавна истраживања су показала да су ГПЦР рецептори слични рецепторима сисара присутни у царству гљива и да се могу класификовати на основу GRAFS система који је базиран на ГПЦР особинама.[68] Идентификација чланова суперфамилије широм еукариотског домена и упоређивање специфичних мотива је довело до закључка да ГПЦР суперфамилија има заједничко порекло.[69] Из анализе карактеристичних мотива следи да су три од пет GRAFS фамилија, родопсинска, адхезиона и увојита, еволуирале из Dictyostelium discoideum cAMP рецептора пре раздвајања Opisthokont таксона. Касније је секретинска фамилија настала из адхезионе рецепторске фамилије, пре него што су се одвојили нематоди.
Dictyostelium discoideum уреди
Нови GPCR који садржи липидно киназни домен је недавно био идентификован код организма Dictyostelium discoideum. Он регулише индикацију ћелијске густине.[70]
Види још уреди
Референце уреди
- ^ Wу, Хуиxиан; Wацкер, Даниел; Милени, Мауро; Катритцх, Всеволод; Хан, ГyеWон; Вардy, Еyал; Лиу, Wеи; Тхомпсон, Аарон А.; Xи-Пинг Хуанг; Ф. Ивy Царролл; С. Wаyне Масцарелла; Рицхард Б. Wесткаемпер; Пхилип D. Мосиер; Брyан L. Ротх; Вадим Цхерезов; Раyмонд C. Стевенс; et al. (2012). „Струцтуре оф тхе хуман к-опиоид рецептор ин цомплеx wитх ЈДТиц”. Натуре. дои:10.1038/натуре10939.
- ^ Кинг Н, Хиттингер ЦТ, Царролл СБ (2003). „Еволутион оф кеy целл сигналинг анд адхесион протеин фамилиес предатес анимал оригинс”. Сциенце. 301 (5631): 361—3. ПМИД 12869759. дои:10.1126/сциенце.1083853.
- ^ Филморе, Давид (2004). „Ит'с а ГПЦР wорлд”. Модерн Друг Дисцоверy. Америцан Цхемицал Социетy. 2004 (Новембер): 24—28.
- ^ Оверингтон ЈП, Ал-Лазикани Б, Хопкинс АЛ (2006). „Хоw манy друг таргетс аре тхере?”. Нат Рев Друг Дисцов. 5 (12): 993—6. ПМИД 17139284. дои:10.1038/нрд2199.
- ^ Роyал Сwедисх Ацадемy оф Сциенцес (10. 10. 2012). „Тхе Нобел Призе ин Цхемистрy 2012 Роберт Ј. Лефкоwитз, Бриан К. Кобилка”. Приступљено 10. 10. 2012.
- ^ а б Гилман А.Г. (1987). „Г Протеинс: Трансдуцерс оф Рецептор-Генератед Сигналс”. Аннуал Ревиеw оф Биоцхемистрy. 56: 615—649. ПМИД 3113327. дои:10.1146/аннурев.би.56.070187.003151.
- ^ Wеттсцхурецк Н, Офферманнс С (2005). „Маммалиан Г протеинс анд тхеир целл тyпе специфиц фунцтионс”. Пхyсиол. Рев. 85 (4): 1159—204. ПМИД 16183910. дои:10.1152/пхyсрев.00003.2005.
- ^ Wанг ХY, Малбон CC (2004). „Wнт-фриззлед сигналинг то Г-протеин-цоуплед еффецторс”. Целл. Мол. Лифе Сци. 61 (1): 69—75. ПМИД 14704854. дои:10.1007/с00018-003-3165-x.
- ^ Бјарнадóттир ТК, Глориам ДЕ, Хеллстранд СХ, Кристианссон Х, Фредрикссон Р, Сцхиöтх ХБ (2006). „Цомпрехенсиве репертоире анд пхyлогенетиц аналyсис оф тхе Г протеин-цоуплед рецепторс ин хуман анд моусе”. Геномицс. 88 (3): 263—73. ПМИД 16753280. дои:10.1016/ј.yгено.2006.04.001.
- ^ Аттwоод ТК, Финдлаy ЈБ (1994). „Фингерпринтинг Г-протеин-цоуплед рецепторс”. Протеин Енг. 7 (2): 195—203. ПМИД 8170923. дои:10.1093/протеин/7.2.195.
- ^ Јр, Колакоwски ЛФ (1994). „ГЦРДб: а Г-протеин-цоуплед рецептор датабасе”. Рецепторс Цханнелс. 2 (1): 1—7. ПМИД 8081729.
- ^ Фоорд СМ, Боннер ТИ, Неубиг РР, Россер ЕМ, Пин ЈП, Давенпорт АП, Спеддинг M, Хармар АЈ (2005). „Интернатионал Унион оф Пхармацологy. XLVI. Г протеин-цоуплед рецептор лист”. Пхармацол Рев. 57 (2): 279—88. ПМИД 15914470. дои:10.1124/пр.57.2.5.
- ^ ИнтерПро
- ^ Јоост П, Метхнер А (2002). „Пхyлогенетиц аналyсис оф 277 хуман Г-протеин-цоуплед рецепторс ас а тоол фор тхе предицтион оф орпхан рецептор лигандс”. Геноме Биол. 3 (11): ресеарцх0063.1—0063.16. ПМЦ 133447 . ПМИД 12429062. дои:10.1186/гб-2002-3-11-ресеарцх0063.
- ^ Бјарнадоттир ТК, Глориам ДЕ, Хеллстранд СХ, Кристианссон Х, Фредрикссон Р, Сцхиотх ХБ (2006). „Цомпрехенсиве репертоире анд пхyлогенетиц аналyсис оф тхе Г протеин-цоуплед рецепторс ин хуман анд моусе”. Геномицс. 88 (3): 263—73. ПМИД 16753280. дои:10.1016/ј.yгено.2006.04.001.
- ^ Вассилатис, D. К.; Хохманн, ЈГ; Зенг, Х; Ли, Ф; Ранцхалис, ЈЕ; et al. (2003). „The G protein-coupled receptor repertoires of human and mouse”. Proc Natl Acad Sci USA. 100 (8): 4903—4908. PMC 153653 . PMID 12679517. doi:10.1073/pnas.0230374100. Архивирано из оригинала 28. 08. 2020. г. Приступљено 28. 08. 2010.
- ^ Qiu JD, Huang JH, Liang RP, Lu XQ (2009). „Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform”. Anal. Biochem. 390 (1): 68—73. PMID 19364489. doi:10.1016/j.ab.2009.04.009.
- ^ Gu Q, Ding YS, Zhang TL (2010). „Prediction of G-Protein-Coupled Receptor Classes in Low Homology Using Chou's pseudo amino acid composition with Approximate Entropy and Hydrophobicity Patterns”. Protein Pept. Lett. 17 (5): 559—67. PMID 19594431. doi:10.2174/092986610791112693.
- ^ Xuan Xiao; Pu Wang; Kuo-Chen Chou (2009). „GPCR-CA: A cellular automaton image approach for predicting G-protein-spregnuti receptor functional classes”. Journal of Computational Chemistry. 30: 1414—1423.
- ^ Grigorieff N, Ceska TA, Downing KH, Baldwin JM, Henderson R (1996). „Electron-crystallographic refinement of the structure of bacteriorhodopsin”. J. Mol. Biol. 259 (3): 393—421. PMID 8676377. doi:10.1006/jmbi.1996.0328.
- ^ Kimura Y, Vassylyev DG, Miyazawa A, Kidera A, Matsushima M, Mitsuoka K, Murata K, Hirai T, Fujiyoshi Y (1997). „Surface of bacteriorhodopsin revealed by high-resolution electron crystallography”. Nature. 389 (6647): 206—11. PMID 9296502. doi:10.1038/38323.
- ^ Pebay-Peyroula E, Rummel G, Rosenbusch JP, Landau EM (1997). „X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases”. Science. 277 (5332): 1676—81. PMID 9287223. doi:10.1126/science.277.5332.1676.
- ^ Palczewski K, Kumasaka T, Hori T, Behnke CA, Motoshima H, Fox BA, Trong IL, Teller DC, Okada T, Stenkamp RE, Yamamoto M, Miyano M (2000). „Crystal structure of rhodopsin: A G protein-coupled receptor.”. Science. 289 (5480): 739—45. PMID 10926528. doi:10.1126/science.289.5480.739.
- ^ Rasmussen SG, Choi HJ, Rosenbaum DM, Kobilka TS, Thian FS, Edwards PC, Burghammer M, Ratnala VR, Sanishvili R, Fischetti RF, Schertler GF, Weis WI, Kobilka BK (2007). „Crystal structure of the human β2-adrenergic G-protein-coupled receptor”. Nature. 450 (7168): 383—7. PMID 17952055. doi:10.1038/nature06325.
- ^ Cherezov V, Rosenbaum DM, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Kuhn P, Weis WI, Kobilka BK, Stevens RC (2007). „High-resolution crystal structure of an engineered human β2-adrenergic G protein-coupled receptor”. Science. 318 (5854): 1258—65. PMC 2583103 . PMID 17962520. doi:10.1126/science.1150577.
- ^ Rosenbaum DM, Cherezov V, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Yao XJ, Weis WI, Stevens RC, Kobilka BK (2007). „GPCR engineering yields high-resolution structural insights into β2-adrenergic receptor function”. Science. 318 (5854): 1266—73. PMID 17962519. doi:10.1126/science.1150609.
- ^ а б Luttrell LM, Lefkowitz RJ (2002). „The role of beta-arrestins in the termination and transduction of G-protein-coupled receptor signals”. J. Cell. Sci. 115 (Pt 3): 455—65. PMID 11861753.
- ^ Millar RP, Newton CL (2010). „The year in G protein-coupled receptor research”. Mol. Endocrinol. 24 (1): 261—74. PMID 20019124. doi:10.1210/me.2009-0473.
- ^ Brass, L. F. (2003). „Thrombin and platelet activation”. Chest. 124 (3 Suppl): 18S—25S. PMID 12970120. doi:10.1378/chest.124.3_suppl.18S.
- ^ Rubenstein, Lester A. & Lanzara, Richard G. (1998). „Activation of G protein-coupled receptors entails cysteine modulation of agonist binding”. Journal of Molecular Structure (Theochem). 430: 57—71. doi:10.1016/S0166-1280(98)90217-2.
- ^ „The biophysical basis for the graphical representations”.
- ^ Wettschureck 2005, стр. 1163
- ^ Kim JY, Haastert PV, Devreotes PN (1996). „Social senses: G-protein-coupled receptor signaling pathways in Dictyostelium discoideum”. Chem. Biol. 3 (4): 239—43. PMID 8807851.
- ^ Duchene J, Schanstra JP, Pecher C, Pizard A, Susini C, Esteve JP, Bascands JL, Girolami JP (2002). „A novel protein-protein interaction between a G protein-coupled receptor and the phosphatase SHP-2 is involved in bradykinin-induced inhibition of cell proliferation”. J Biol Chem. 277 (43): 40375—83. PMID 12177051. doi:10.1074/jbc.M202744200.
- ^ Chen-Izu Y, Xiao RP, Izu LT, Cheng H, Kuschel M, Spurgeon H, Lakatta EG (2000). „G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels”. Biophys. J. 79 (5): 2547—56. PMC 1301137 . PMID 11053129. doi:10.1016/S0006-3495(00)76495-2.
- ^ а б Tan CM, Brady AE, Nickols HH, Wang Q, Limbird LE (2004). „Membrane trafficking of G protein-coupled receptors”. Annu. Rev. Pharmacol. Toxicol. 44: 559—609. PMID 14744258. doi:10.1146/annurev.pharmtox.44.101802.121558.
- ^ Krueger KM, Daaka Y, Pitcher JA, Lefkowitz RJ (1997). „The role of sequestration in G protein-coupled receptor resensitization. Regulation of β2-adrenergic receptor dephosphorylation by vesicular acidification”. J. Biol. Chem. 272 (1): 5—8. PMID 8995214. doi:10.1074/jbc.272.1.5.
- ^ Laporte SA, Oakley RH, Holt JA, Barak LS, Caron MG (2000). „The interaction of β-arrestin with the AP-2 adaptor is required for the clustering of β2-adrenergic receptor into clathrin-coated pits”. J. Biol. Chem. 275 (30): 23120—6. PMID 10770944. doi:10.1074/jbc.M002581200.
- ^ Laporte SA, Oakley RH, Zhang J, Holt JA, Ferguson SS, Caron MG, Barak LS (1999). „The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis”. Proc. Natl. Acad. Sci. U.S.A. 96 (7): 3712—7. PMC 22359 . PMID 10097102. doi:10.1073/pnas.96.7.3712.
- ^ Wolfe, Breann L.; Trejo, JoAnn (2007). „Clathrin-Dependent Mechanisms of G Protein-coupled Receptor Endocytosis”. 8 (5): 462—470. doi:10.1111/j.1600-0854.2007.00551.x.
- ^ Maggio, R.; Vogel, Z.; Wess, J. (1993). „Coexpression studies with mutant muscarinic/adrenergic receptors provide evidence for intermolecular "cross-talk" between G-protein-linked receptors” (PDF). Proc. Natl. Acad. Sci. U.S.A. 90: 3103.
- ^ Maggio, R.; Barbier, P.; Fornai, F.; Corsini, G. U. (1996). „Functional role of the third cytoplasmic loop in muscarinic receptor dimerization”. J. Biol. Chem. 271: 31055.
- ^ а б Bouvier, M. (2001). „Oligomerization of G-protein-coupled transmitter receptors.”. Nat. Rev. Neurosci. 2: 274.
- ^ а б Milligan, G. J. Cell Sci. 2001, 114, 1265.
- ^ а б Rios, C. D.; Jordan, B. A.; Gomes, I.; Devi, L. A. Pharmacol. Ther. 2001, 92, 71.
- ^ а б George, S. R.; O’Dowd, B. F.; Lee, S. P. Nat. Rev. Drug Discovery 2002, 1, 808.
- ^ а б Agnati, L. F.; Ferre, S.; Lluis, C.; Franco, R.; Fuxe, K. Pharmacol. Rev. 2003, 55, 509.
- ^ а б Franco, R.; Canals, M.; Marcellino, D.; Ferre, S.; Agnati, L.; Mallol, J.; Casado, V.; Ciruela, F.; Fuxe, K.; Lluis, C.; Canela, E. I. (2003). „Marked changes in signal transduction upon heteromerization of dopamine D1 and histamine H3 receptors”. Trends Biochem. Sci. 28: 238. doi:10.1111/j.1476-5381.2009.00152.x.
- ^ а б Kroeger, K. M.; Pfleger, K. D.; Eidne, K. A. Front Neuroendocrinol. 2003, 24, 254
- ^ а б в Terrillon, S.; Bouvier, M. EMBO Rep. 2004, 5, 30.
- ^ Park, P. S.; Filipek, S.; Wells, J. W.; Palczewski, K. Biochemistry 2004, 43, 15643.
- ^ а б Maggio, R.; Novi, F.; Scarselli, M.; Corsini, G. U. FEBS J. 2005, 272, 2939.
- ^ Bulenger, S.; Marullo, S.; Bouvier, M. Trends Pharmacol. Sci. 2005, 26, 131.
- ^ а б Margeta-Mitrovic M, Jan YN, Jan LY (2000). „A trafficking checkpoint controls GABA(B) receptor heterodimerization”. Neuron. 27 (1): 97—106. PMID 10939334. doi:10.1016/S0896-6273(00)00012-X.
- ^ White JH, Wise A, Main MJ, Green A, Fraser NJ, Disney GH, Barnes AA, Emson P, Foord SM, Marshall FH (1998). „Heterodimerization is required for the formation of a functional GABA(B) receptor”. Nature. 396 (6712): 679—82. PMID 9872316. doi:10.1038/25354.
- ^ Kaupmann, K.; Malitschek, B.; Schuler, V.; Heid, J.; Froestl, W.; Beck, P.; Mosbacher, J.; Bischoff, S.; Kulik, A.; Shigemoto, R.; Karschin, A.; Bettler, B. Nature 1998, 396, 683.
- ^ Marshall, F. H.; Jones, K. A.; Kaupmann, K.; Bettler, B. Trends Pharmacol. Sci. 1999, 20, 396.
- ^ Mohler, H.; Fritschy, J. M. Trends Pharmacol. Sci. 1999, 20, 87.
- ^ Kunishima, N.; Shimada, Y.; Tsuji, Y.; Sato, T.; Yamamoto, M.; Kumasaka, T.; Nakanishi, S.; Jingami, H.; Morikawa, K. (2000). „Structural basis of glutamate recognition by a dimeric metabotropic glutamate receptor”. Nature. 407: 971. doi:10.1038/35039564.
- ^ Bockaert, J.; Pin, J. P. (1999). „Molecular tinkering of G protein-coupled receptors: an evolutionary success”. EMBO J. 18: 1723. doi:10.1093/emboj/18.7.1723.
- ^ Zhu, X.; Wess (1998). „Truncated V2 vasopressin receptors as negative regulators of wild-type V2 receptor function”. J. Biochemistry. 37: 15773.
- ^ Morello, J. P.; Salahpour, A.; Laperriere, A.; Bernier, V.; Arthus, M. F.; Lonergan, M.; Petaja-Repo, U.; Angers, S.; Morin, D.; Bichet, D. G.; Bouvier, M. (2000). „Pharmacological chaperones rescue cell-surface expression and function of misfolded V2 vasopressin receptor mutants”. J. Clin. Invest. 105: 887. doi:10.1172/JCI8688.
- ^ Benkirane, M.; Jin, D. Y.; Chun, R. F.; Koup, R. A.; Jeang, K. T. (1997). „Mechanism of transdominant inhibition of CCR5-mediated HIV-1 infection by ccr5delta32”. J. Biol. Chem. 272: 30603.
- ^ Dean, M. K.; Higgs, C.; Smith, R. E.; Bywater, R. P.; Snell, C. R.; Scott, P. D.; Upton, G. J.; Howe, T. J.; Reynolds, C. A. (2001). „Dimerization of G-protein-coupled receptors”. J. Med. Chem. 44: 4595.
- ^ Filipek, S.; Krzysko, K. A.; Fotiadis, D.; Liang, Y.; Saperstein, D. A.; Engel, A.; Palczewski, K. (2004). „A concept for G protein activation by G protein-coupled receptor dimers: the transducin/rhodopsin interface.”. Photochem. Photobiol. Sci. 3: 628.
- ^ Hamm, H. E. (2001). „How activated receptors couple to G proteins” (PDF). Proc. Natl. Acad. Sci. U.S.A. 98: 4819. doi:10.1073/pnas.011099798. Архивирано из оригинала (PDF) 27. 10. 2016. г. Приступљено 27. 10. 2016.
- ^ Baneres, J. L.; Parello, J. J. (2003). „G Protein Activation by the Leukotriene B4 Receptor Dimer”. Mol. Biol. 329: 815. doi:10.1074/jbc.M710419200.
- ^ Krishnan, A.; Alme´n MS; Fredriksson, R; Schiöth, HB (2012). „The Origin of GPCRs: Identification of Mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in Fungi”. PLoS ONE: e29817. PMID 22238661. doi:10.1371/journal.pone.0029817.
- ^ Nordström KJ, Sällman Almén M, Edstam MM, Fredriksson R, Schiöth HB (2011). „Independent HHsearch, Needleman–Wunsch-Based, and Motif Analyses Reveal the Overall Hierarchy for Most of the G Protein-Coupled Receptor Families”. Mol Biol Evol: 2471—80. PMID 21402729. doi:10.1093/molbev/msr061.
- ^ Bakthavatsalam D, Brazill D, Gomer RH, Eichinger L, Rivero F, Noegel AA (2007). „A G protein-coupled receptor with a lipid kinase domain is involved in cell-density sensing”. Curr Biol. 17 (10): 892—7. PMID 17481898. doi:10.1016/j.cub.2007.04.029.
Literatura уреди
- Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE, Mortrud MT, Brown A, Rodriguez SS, Weller JR, Wright AC, Bergmann JE, Gaitanaris GA (2003). „The G protein-coupled receptor repertoires of human and mouse”. Proc Natl Acad Sci USA. 100 (8): 4903—8. PMC 153653 . PMID 12679517. doi:10.1073/pnas.0230374100.
- „A phylogenetic tree of all human GPCRs” (PDF). Приступљено 11. 8. 2008.
- „GPCR Database”. IUPHAR Database. International Union of Basic and Clinical Pharmacology. Архивирано из оригинала 15. 09. 2008. г. Приступљено 11. 8. 2008.
- Vriend G, Horn F (29. 6. 2006). „GPCRDB: Information system for G protein-coupled receptors (GPCRs)”. Molecular Class-Specific Information System (MCSIS) project. Архивирано из оригинала 25. 04. 2019. г. Приступљено 11. 8. 2008.
- UMich оријентација протеина у мембранама фамилиес/суперфамилy-6
- „ГПЦР Референце Либрарy”. Приступљено 11. 8. 2008. „Референце фор молецулар анд матхематицал моделс фор тхе инитиал рецептор респонсе”
- Ji T.H., Grossmann M. & Ji I. (1998). G protein-coupled receptors. I. Diversity of receptor-ligand interactions. J. Biol. Chem., 273, 17299–17302.
- Gether U. & Kobilka B.K. (1998). G protein-coupled receptors. II. Mechanism of agonist activation. J. Biol. Chem., 273, 17979–17982.
- Lefkowitz, R.J. (1998). G protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J. Biol. Chem., 273, 18677–18680.
- Pierce K.L., Premont R.T., Lefkowitz R.J. (2002). Seven-transmembrane receptors. Nat. Rev. Mol. Cell. Biol. 9, 639-50
- Lefkowitz, R.J. & Whalen, E.J. (2004). Beta-arrestins: traffic cops of cell signaling. Curr. Opin. Cell Biol., 16, 162–168.
- Lefkowitz, R.J. & Shenoy, S.K. (2005). Transduction of receptor signals by beta-arrestins. Science 308, 512–517.
- Fredriksson R. & Schiöth H.B. (2005). The Repertoire of G-Protein–Coupled Receptors in Fully Sequenced Genomes. Mol. Pharmacol., 67, 1414–1425.
- Hill S.J. (2006). G-protein-coupled receptors: past, present and future. Br. J. Pharmacol., 147, S27-S37.
- Lodish, Berk, Zipursky, Matsudaira: „Molekulare Zellbiologie“ 4. Auflage S. 922ff.
- Бруце Албертс; Алеxандер Јохнсон; Јулиан Леwис; Мартин Рафф; Кеитх Робертс; Петер Wалтер (2002). Молецулар Биологy оф тхе Целл. Неw Yорк: Гарлард Сциенце. ISBN 0815332181.
- Доналд Воет; Јудитх Г. Воет (2005). Биоцхемистрy (3 изд.). Wилеy. ИСБН 9780471193500.
Спољашње везе уреди
- Г-протеин-цоуплед+рецепторс на US National Library of Medicine Medical Subject Headings (MeSH)
- Рецептори спрегнути с Г протеином - МАПК/Ерк сигнализација
- ГПЦР Целл Лине
- „ГПЦР Датабасе”. ИУПХАР Датабасе. Интернатионал Унион оф Басиц анд Цлиницал Пхармацологy. Архивирано из оригинала 15. 09. 2008. г. Приступљено 22. 08. 2010.
- Вриенд Г, Хорн Ф (29. 6. 2006). „ГПЦРДБ: Информатион сyстем фор Г протеин-цоуплед рецепторс (ГПЦРс)”. Молецулар Цласс-Специфиц Информатион Сyстем (МЦСИС) пројецт. Архивирано из оригинала 25. 04. 2019. г. Приступљено 22. 08. 2010.
- „Г Протеин-Цоуплед Рецепторс он тхе НЕТ”. Приступљено 10. 11. 2010. „а цлассифицатион оф ГПЦРс”
- „ПСИ ГПЦР Нетwорк Центер”. Архивирано из оригинала 25. 07. 2013. г. Приступљено 24. 08. 2018. „а Протеин Струцтуре Инитиативе:Биологy Нетwорк Центер аимед ат детермининг тхе 3Д струцтурес оф репресентативе ГПЦР фамилy протеинс”